Дидактичні ігри на уроках хімії
Останнє редагування: 2018-01-30
Автор: Гуйван Тетяна Володимирівна
Методичний посібник містить деякі види дидактичних ігор. У поєднанні з іншими педагогічними технологіями вони підвищують ефективність педагогічної освіти. Розробки ігрових завдань передбачають індивідуальні та групові форми роботи. Матеріали посібника можна застосовувати для активізації знань, під час перевірки домашнього завдання, на етапах вивчення нового матеріалу та закріплення знань. Введення ігрових елементів на уроках хімії дозволяє підвищити зацікавленість учнів предметом, стимулювати їхній інтелектуальний розвиток.
ЗМІСТ
ВСТУП………………………………………………………………………....3
РОЗДІЛ І. ДИДАКТИЧНА ГРА НА УРОКАХ ХІМІЇ………………………5
1.1. Дидактична гра, як засіб що стимулює процес навчання………………5
1.2. Вплив дидактичної гри на ефективність навчання……………………..6
1.3. Алгоритм розробки і проведення дидактичних ігор……………………9
РОЗДІЛ ІІ. ПРИКЛАДИ ВИКОРИСТАННЯ ДИДАКТИЧНИХ ІГОР НА РІЗНИХ ЕТАПАХ УРОКУ ХІМІЇ…………………………………………………12
2.1. Методичні розробки дидактичних ігор (із зазначенням рекомендованих тем уроків)……………………………………………………….12
2.2. Розробка уроку із застосуванням дидактичних ігор…….....................28
2.3. Навчальна гра «Інтелект – мій вибір»…………………………………39
Висновки……………………………………………………………………..53
Список використаних джерел…..………………………………………….54
Додатки………………………………………………………………………55
ВСТУП
Провідна діяльність в старшому шкільному віці - навчання. Саме ця діяльність тягне за собою вирішальний вплив на емоційне благополуччя, психічний і соціальний розвиток учнів. Її компоненти виробляються поступово, тому важливо використовувати ті форми, які могли б служити в якості емоціональної підтримки в процесі навчання, що сприяє адаптації учнів до нових видів діяльності. Однією з таких форм, освоєних учнями, є гра. Граючи, дитина працює зі знаннями про навколишній світ, пізнає його глибше, вчиться ставити перед собою цілі, розробляти план дій.
Застосування гри стає актуальним в даний час через збільшення насиченості сучасного школяра інформацією яку він отримує з телебачення, відео, радіо, комп'ютерних мереж. Актуальним завданням школи стає розвиток самооцінки та відбору одержуваної інформації. Однією з форм навчання, що розвиває ці навички, є дидактична гра, котра сприяє практичному застосуванню знань, отриманих як на уроці так і в позаурочний час.
Дидактична гра - активна навчальна діяльність з системою моделювання досліджуваних систем, явищ, процесів, її предмет сама людська діяльність.
Дидактична гра - це така навчальна діяльність, в якій кожен учасник гри і команда в цілому цілеспрямовано розв’язують головні задачі і орієнтують свою поведінку, щоб виграти.
Гра для учнів є найбільш цікавою формою діяльності тому, що в ній залишаються ознаки і форма звичайної гри, але цілі змінюються. Одержання задоволення, властиве для звичайної гри, вже стає на задній план, в той час як задача дидактичної гри: «Фундаментальне засвоєння знань, розвиток вмінь і виховання учнів», що були в невидимій формі, набувають першочергового значення. Під впливом захопленості, котру виробляє ігрова ситуація, спочатку нецікавий і незрозумілий матеріал засвоюється легше і більш успішно, тому що граючись учні проявляють активність – головний фактор навчання. Процес навчання стає більш ефективним, тому що при виконанні навчальних завдань учням надається більше свободи фантазії. Тому слід шукати можливості, щоб використовувати ігри при підготовці школярів опанувати важливі хімічні ідеї, іншими словами навчати хімії в процесі гри.
Хоча гра дарує щохвилинну радість, вона спрямована на майбутнє, бо коли діти грають у них формуються і закріплюються вміння, здібності, які в майбутньому будуть необхідні їм для виконання професійних творчих задач.
РОЗДІЛ І.
ДИДАКТИЧНІ ІГРИ НА УРОКАХ ХІМІІЇ
1.1. Дидактична гра, як засіб що стимулює процес навчання.
«Людина грає тільки тоді, коли він є людиною
в повному значенні цього слова,
і тільки тоді він є справжньою людиною, коли він грає»
Шиллер
Відомий давньогрецький філософ Аристотель ще в середині ІV століття до н.е. вважав, що корінь освіти гіркий. Але якщо учитель закликає в помічники інтерес, коли діти прагнуть до знань і до активної розумової праці, «корінь навчання змінює смак і викликає у дітей цілком здоровий апетит» [1].
Як же прищеплювати інтерес до хімії, щоб підтримувати активність під час уроку?
Проблема результативності навчання тісно зв'язана з активністю, самостійністю учнів, бажанням їх пізнати основи науки, що вивчає, підштовхує своїми пізнавальними мотивами до навчальної діяльності. Одним із засобів, що стимулює процес навчання хімії, є дидактична гра, яка сприяє доступному і швидкому засвоєнню знань і умінь. «Казка, гра, фантазія – життєдайне джерело дитячого мислення, благородних почуттів та прагнень,» - писав В. Сухомлинський [2].
Як доросла людина не може існувати без праці, так і дитина не може існувати без гри, тому що під час гри дитина росте, розвивається її творчий потенціал, увага, пам’ять, уява, мислення. А все це сприяє результативності навчання в цілому.
У дидактичній грі формуються позитивні пізнавальні мотиви для навчання хімії за допомогою захоплюючих конкурсів і змагань.
У дидактичній грі відбувається виховання учнів, тому що в процесі підготовки і проведення діти вчяться культурі спілкування, навичкам працювати в команді, долати психологічні перешкоди, тобто вони працюють над собою, своїми звичками і виробляють характер.
Дидактична гра на уроці змінює емоційну атмосферу, яка стає більш жвавою, пропадає стрес, втома і дозволяє налаштувати учнів на засвоєння нової інформації. При цьому також змінюються відносини між учителем і учнями в кращий бік.
Під час і гри учні навчаються зосереджуватися, самостійно мислити, бути більш уважними. Захопившись грою, діти не будуть помічати, що навчаються, починають працювати навіть найпасивніші учні. Але не варто надавати велику увагу іграм, може виникнути несерйозний підхід до вивчення хімії. Дидактична гра може розглядатися як відпочинок або розрада на уроці. Ні в якому разі не можна перетворювати навчання на гру. Дидактична гра - це важливий методологічний інструмент, що дозволяє невільно включити учня в активний творчий навчальний процес. І, як будь-який інший метод навчання, дидактична гра в школі повинна бути використана тільки в поєднанні з іншими методами і прийомами навчання [3].
1.2.Вплив дидактичної гри на ефективність навчання
Виділяють три найбільш важливі і завжди присутні функції дидактичної гри:
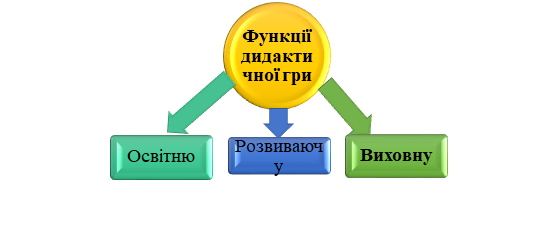
Рис.1.1 – Функції дидактичної гри
Дидактичні ігри, які розрізняються за метою, формою, змістом, по суті своїй являють собою різні інтелектуальні завдання, пояснення матеріалу, його повторення, узагальнення в цікавій формі. Цікавість при цьому є тільки засобом, підлеглим цілям навчання, виховання і розвитку.
На початку підготовки або проведення дидактичної гри необхідно використовувати її цікавість, котра реалізується за допомогою ігрових атрибутів, оригінального оголошення на початку гри і привертає увагу учнів.
Наприклад, при проведенні гри «Складіть слова» учні звертають увагу на плакат з барвистими літерами, а в грі «Ромашка» вони бачать ромашку з відірваними пелюстками, і їх увагу привертає не сам предмет , а його присутність на уроці. Тут же змінюється емоціональний настрій в класі. Учні, зосередившись, уважно слухають умови проведення гри, які побуджають їх до ігрової діяльності.
Елементи забави служать також засобом розвитку мотиваційної сфери навчальної діяльності, що сприяють підвищенню результатів навчання, так як щоб виграти в дидактичної гри необхідно, перш за все, знати предмет.
Байдужість вчитися в ігровій ситуації щезає тому, що виникає бажання бути першим, азарт. В ігрову діяльність залучаються навіть пасивні учні. Але щоб виграти, необхідні знання вивченого матеріалу, а також інтелект, кмітливість, уміння порівнювати, робити висновки. Для того, щоб бути першим у грі «Ромашка», необхідно мати вірне уявлення про властивості основ та кислот.
Ще одним фактором у формуванні пізнавального інтересу під час використання дидактичної гри є проблемна ситуація, коли учні, наприклад, здійснюючи подорож в країну «Основні класи неорганічних сполук », повинні пояснити сутність хімічних процесів, що відбуваються в навколишньої середовищі. Одні питання і завдання вимагають застосування раніше добутих знань, прояви кмітливості, інші - ерудиції та використання додаткової інформації. Слід зазначити, що знання в дидактичної гри учні отримують не тільки від учителя, вони самі стають учасниками їх пошуку, обмінюючись між собою інформацією, способами її отримання.
Елементи інтересу в дидактичної гри служать в якості розрядки напруженості в класі і допомагають учням зосередитися для подальшої поглибленої роботи над предметом або явищем. Під час проведення дидактичної гри розвиваються різнобічні мотиви дітей. Одних приваблює ігровий мотив - змагання, вони багато фантазують або захоплюються азартною обстановкою, для інших головний мотив – пізнавальний [4].
Головна функція дидактичної гри - навчальна функція, основою якої є дидактична мета, що в ігровій ситуації ставиться перед учнями у вигляді проблемної ігрової задачі. Учні засвоюють основні вимоги роботи з навчальним матеріалом і застосовують ці навички при розв’язку інших завдань, де ці знання і вміння знадобляться. Наприклад, при вивченні теми «Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва» учні 8 класу повинні засвоїти поняття про класифікацію хімічних елементів шляхом історичного і логічного підходу. Під час проведення дидактичної гри в цікавій формі за допомогою карток і залученням методу історизму учні пізнають послідовність формування і розвитку періодичного закону, періодичної системи і їх науковий зміст. Засвоївши в наочній і доступній формі основні принципи побудови періодичної системи, учні використовують їх при вивченні будови речовини, хімії елементів. У цьому випадку дидактична гра виконує роль засобу, за допомогою якого організовується процес засвоєння, удосконалюються знання учнів про властивості металів та неметалів, про основні класи неорганічних сполук, генетичний зв'язок неорганічних речовин і основних законів хімії.
Виховна функція дидактичної гри - формування позитивного ставлення до предмету, бажання вивчати хімію, пізнання нового, старанність і працьовитість. При правильній організації гри в учнів формується здатність до дискусії, відстоювати свою точку зору. У грі виховуються такі якості особистості, як цілеспрямованість, продуктивність мислення, сила волі, активність, віра в себе, загартовуються такі риси характеру, як взаємодопомога і партнерство. Навіть найбільш пасивні учні роблять все можливе, щоб не підвести товаришів по команді. У грі дитина стає розкутою, вона набуває впевненості в своїх силах, а при досягненні перемоги у неї виникає велике бажання грати знову.
Дидактична гра виконує також розвиваючу функцію. При проведенні ігор «Хто зайвий?», «Знайди помилку» ставиться мета не тільки закріпити знання хімічної символіки, полегшити запам'ятовування назв хімічних елементів, але й удосконалювати пам'ять, увагу, розвинути уяву, інтуїцію, спостережливість. Таким чином, дитина вчиться і розвивається.
Отже, дидактична гра через цікавість, триєдині функції допомагає вирішувати проблеми навчання. Тому дидактичні ігри слід використовувати в ході навчання, причому систематично, а не час від часу.
Але не слід закликати перетворити навчання на гру. Гра – не те, що саме по собі є метою, а метод навчання, що спонукає до підвищення активізації навчальної діяльності школярів, використання, якого в поєднанні з іншими методами допомагає зробити свій конкретний внесок у вирішення навчально-виховних завдань загальноосвітньої школи.
1.3. Методичні рекомендації по розробці та використанню дидактичних ігор
Дидактичні ігри використовують з метою отримання певного результату. Дітей до дидактичних ігор слід готувати заздалегідь, враховуючи педагогічні і психологічні аспекти, час проведення, атрибути і правила гри. Це дозволяє настроїти дітей, щоб вони творчо підготувалися до гри. Для дітей з яскраво вираженою активністю на уроці не слід проводити ігри, метою яких є запам’ятовування тих чи інших хімічних понять, законів, тощо – з ними краще проводити ігри, котрі дають можливість продемонструвати ерудицію і дотепність, отже, мають змагальний характер.
Складаючи сценарій, правила і назву гри потрібно пам’ятати, щоб в ній переважали елементи забави, цікавості, змагання, але й не забувати, що гра не повинна бути занадто азартною.
Дидактична гра повинна забезпечити розумову і творчу діяльність учнів, відповідати їх віку, рівню підготовки і кругозору учнів. Починати гру слід з більш простих завдань, поступово переходячи до більш ускладненим. Завдання гри повинні бути захопливими і мати кілька варіантів відповідей (навіть нестандартних), щоб у учнів був вибір.
Атрибути гри повинні бути яскравими, загадковими, красивими, незвичайними. Правила гри повинні бути простими і чітко сформульованими, щоб дитина добре змогла зрозуміти хід і зміст гри, її правила цілі. Під час гри необхідні порядок і дисципліна. Підведення підсумків гри має бути відкритим, справедливим, емоційним і фіксуватися таким чином, щоб їх бачили всі. Для підрахунку результатів слід вибрати журі, при необхідності призначають помічників-консультантів з учнів.
Найкраще гру проводити в швидкому темпі, щоб кожен учень прийняв участь в грі. Тому попередньо слід розрахувати час тривалості кожного туру або етапу гри і обов’язково дотримуватися його. Тривалі за часом ігри проводити не доречно, бо учні втомлюються, втрачають інтерес, та й такі ігри потребують трудомісткої підготовки. Більш ефективні за результатом ігри, нетривалі (5-10 хвилин).
Також дидактична гра допомагає і вчителю. ЇЇ застосування скорочує час, щоб перевірити знання великої кількості учнів, за 5-10 хвилин вчитель під час гри має можливість проконтролювати рівень засвоєння матеріалу. Учитель повинен бути активним учасником гри, слідкувати за тим, щоб інтерес у дітей до гри не знижувався. Потрібно вміло налаштувати гру так, щоб не було втрати однієї команди з «сухим» рахунком, щоб під час гри встановлювався нормальний психологічний клімат, активізувалася робота пасивних учнів. Іноді корисно ввести в правила гри штрафні та заохочувальні бали.
Велике значення має підведення підсумків, так як дає учасникам моральне задоволення. Їх оголошують відразу після гри. Проводячи позакласний захід слід продумати призи, які мають бути ефектними та викликати у переможців лише позитивні емоції. Це може бути торт, цукерки, книга або самородні значки і медалі або право на проведення цікавих хімічних дослідів. У будь-якому випадку результати гри слід оцінити у вигляді оцінок в класному журналі.
Дидактичні ігри добре застосовувати при вивченні тем, які формують загальні хімічні поняття (початкові хімічні поняття, періодична система хімічних елементів, основні класи неорганічних речовин, тощо), які сприяють засвоєнню, закріпленню, узагальненню і систематизації вивченого. При вивченні навчальних тем, де більш конкретний зміст (наприклад, хімії елементів, швидкості хімічної реакції тощо), де відбувається поглиблення раніше отриманих знань, проводити дидактичну гру не має сенсу. Її краще проводити на узагальнюючому уроці з вивченої теми, тоді це буде більш продуктивним. Частіше уроки з використанням дидактичних ігор проводяться в 8 класі, так як учні із задоволенням включаються в таку форму навчального процесу і засвоюють досліджуваний матеріал. У старших класах необхідність в нетривалих дидактичних іграх слабшає, тому що вивчення хімії відбувається в учнів більш усвідомлено.
Сюжетно-рольові ігри краще проводити в старших класах (10-11 класи), так як вони мають профорієнтаційну направленість; в їх підготовці необхідно враховувати не тільки вік, а й індивідуальні особливості учнів, характер кожного учасника гри; ці ігри вимагають більш ретельної і трудомісткої підготовки, як з боку вчителя, так і з боку учнів. З огляду на ці особливості сюжетно-рольових ігор, вчитель матиме можливість проводити їх систематично, не більше ніж 1-2 рази на рік.
Дидактичні ігри доцільно застосовувати при проведенні факультативних занять з хімії, за допомогою гри можна розвивати інтерес до хімічної науки і допомогти дітям освоювати її початкові поняття, щоб досліджуваний матеріал був для них більш доступний.
Проте, занадто часте використання дидактичних ігор на уроці призводить до ситуації, коли учні будуть сприймати курс вивчення хімії як гру в цілому. Таким чином учитель повинен запобігти перенасиченню навчального процесу ігрової діяльністю.
РОЗДІЛ ІІ.
ПРИКЛАДИ ВИКОРИСТАННЯ ДИДАКТИЧНИХ ІГОР НА РІЗНИХ ЕТАПАХ УРОКУ ХІМІЇ
2.1. Методичні розробки дидактичних ігор (із зазначенням рекомендованих тем уроків)
Дидактичні ігри можна застосовувати на різних етапах уроку: при вивченні нового матеріалу, при формуванні, повторенні та закріплювання знань, при перевірці знань та вмінь, при узагальненні знань.
Припустимо, що після вивчення початкових хімічних понять вчитель ставить перед собі мету перевірити ступінь їх засвоєння за допомогою дидактичної ігри. Отже, дидактична функція в даному випадку визначається як контроль знань найважливіших хімічних термінів.
При поясненні нового матеріалу доцільно застосовувати ігри, використовуючи історичний і логічний підхід, щоб учні здатні були уявити і відчути рівень розвитку науки на той час .
Базову складову цих ігор можна застосовувати при вивченні різних тем, міняючи зміст завдання, також приводиться сценарій гри, яку можна використати як позакласний заході.
Розглянемо конкретні приклади прикладі застосування загальних рекомендацій для розробки та проведення гри,
Тема «Початкові хімічні поняття».
«Знайді спільні та відмінні ознаки»
Гра тренує вміння давати порівняльну характеристику. Учитель пропонує учням два хімічних об'єкта: дві речовини, два елементи, фізичне і хімічне явища, два хімічних явища, суміш і сполуку. Учні повинні знайти і виписати в дві колонки якомога більше спільних ознак і відмінностей цих об'єктів. Потім школярі об'єднуються в пари або четвірки і складають загальний список. Вголос зачитують найдовший перелік, його доповнюють ознаками, які не були зазначені, зі списків інших груп. Подальша робота зі списком може бути різною. Можна запропонувати учням виділити найбільш істотні ознаки і аргументувати свій вибір або вибрати ознаки, які допоможуть: а) розрізнити об'єкти; б) розділити об'єкти; в) класифікувати об'єкти.
«Третій зайвий»
При закріпленні понять «проста речовина», « складна речовина», щоб розвинути увагу учнів, виробити вміння швидко знаходити правильні і відкидати неправильні судження можна провести цю гру у вигляді карток, на яких написано 5-6 ( за числом учнівських парт в ряду) рядків назв простих та складних речовин. Учні розбиваються на 3 команди (по рядах столів в класі). Кожна команда отримує картку. Учні викреслюють або виписують в зошит назви простих і складних речовин і зраджують картку наступному столу(таблиця 2.1.).
Таблиця 2.1.
|
Прості речовини |
Складні речовини |
|
Хром, сажа, вода |
Алюміній, сірка, натрій хлорид |
|
Оксид цинку, цинк, йод |
Хлороводень, хлор, азот |
|
Залізо, сірководень, мідь |
Магній оксид, цинк хлорид, вода |
|
Залізо, сірчана кислота, кисень |
Алюміній, сірчистий газ, озон |
|
Хлорид натрію, водяна пара, водень |
Кухонна сіль, залізо, сірковуглець |
|
Хлор, сульфід натрію, магній |
Бром, питна сода, калій оксид |
«Руки вгору»
Метою цієї гри - активізація уваги учнів, закріплення основних хімічних понять, наприклад «речовина», «фізичне тіло», ще при цієї грі розвиваються увага. Атрибутами гри є картки для вчителя з переліком різних речовин і фізичних тіл. Учитель перераховує назви речовин і фізичних тіл, учні уважно слухають і дивляться на картки. Якщо названа речовина, то учні піднімають руки вгору, а якщо фізичне тіло, то руки залишаються на парті.
Якщо учень допускає помилку, він дає визначення тіла або речовини з прикладами.
Приклад переліку назв (таблиця 2.2):
Таблиця 2.2.
|
Пробірка |
Кальцій |
Сіль |
Книжка |
|
Чашка |
Мідь |
Сніг |
Склянка |
|
Гвинт |
Тирса |
Лінійка |
Ручка |
|
Вода |
Глюкоза |
М’яч |
Зошит |
|
Спирт |
Вуглекислий газ |
Олівець |
ваза |
Схожу гру можна провести при вивченні тем «Чисті речовини і суміші», «Фізичні та хімічні явища».
«Впізнай мене»
Щоб закріпити поняття «суміш», «хімічний елемент», «хімічна сполука» можна провести гру, суть якої полягає в тому, щоб з букв, відповідних правильним відповідям, отримаєте назву хімічного елемента (таблиця 2.3).
Таблиця 2.3
|
Назва |
суміш |
Хімічна сполука |
Хімічний елемент |
|
Магній оксид |
М |
С |
П |
|
Молоко |
И |
Р |
З |
|
Спирт |
В |
Л |
Б |
|
Пісок |
Е |
І |
Ж |
|
Купрум |
К |
Л |
Ц |
|
Хлор |
Ч |
Х |
І |
|
Аргентум |
З |
Т |
Й |
«Побудуй фігури»
Хімічний диктант проводять з метою перевірки знання хімічних знаків і їх зображення. Кожному учневі видають аркуш паперу з безладно розставленими точками, кожній з яких відповідає знак хімічного елемента.
Учитель в певній послідовності називає хімічні елементи (Фосфор, Калій, Нітроген, Сульфур, Флуор, Оксиген, Магній, Кальцій, Натрій, Гідроген, Ртуть, Ферум, Фосфор), а школярі з'єднують знаки цих елементів прямими лініями в тій же послідовності (рисунок 2.1).
В результаті повинні вийти певні фігури
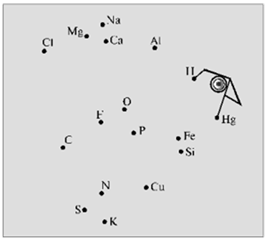
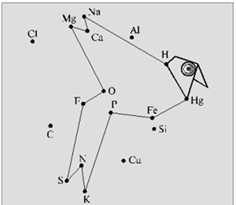
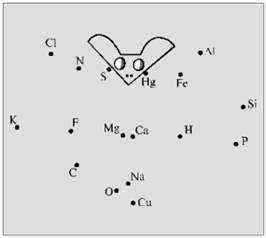
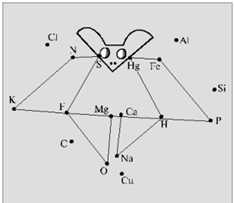
Рис.2.1 – «Побудуй фігури»
Тема: «Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома».
«Логічні ланцюги»
Учитель задає початок фрази: "Натрій - метал". Перший учень повторює його і придумує продовження зі словами "тому що", "отже", "тому". Потім все сказане повторює і продовжує наступний учень. Той, хто не зміг продовжити ланцюжок, вибуває з гри. Далі вчитель пропонує нову фразу.
«Віднови пропущене».
У клітинах ігрового поля записані знаки хімічних елементів, в деяких з них – знак питання. Відомо що:
1. по периметру квадрата знаходяться символи елементів тільки головних підгруп і тільки металів;
2. в верхньому і нижньому рядах закономірно змінюється число електронів на зовнішньому енергетичному рівні атомів елементів;
3. в середньому ряду - знаки елементів II групи;
4. по діагоналі зліва направо записані знаки елементів, що утворюють амфотерні оксиди і гідроксиди.
|
Al |
? |
Na |
|
? |
Zn |
Ca |
|
R |
Sr |
? |
Відповідь:
|
|
Mg |
Na |
|
Ba |
Zn |
Ca |
|
R |
Sr |
Ga |
«Спіймай помилку»
Також учням подобаються вправи на розшифрування термінів, явищ тощо. При вивченні у 8 класі теми «Характеристика хімічних елементів малих періодів за місцем положення в Періодичній системі та будовою атома» актуалізацію опорних знань можна провести, виконавши вправу:
Спіймай помилки та склади слово:
1. (А) Головна характеристика хімічного елемента – це його відносна атомна маса.
2. (М) Кількість протонів дорівнює порядковому номеру елемента.
3. (Е) Періоди – це горизонтальні ряди в таблиці Д.І. Менделєєва.
4. (У) Групи бувають великими та малими.
5. (Н) Нітроген, Фосфор, Арсен становлять головну підгрупу четвертої групи.
6. (Д) У Магнію на зовнішньому рівні два електрони.
7. (К) У Силіцію 14 нейтронів.
8. (Е) У Купруму заряд ядра +29.
9. (У) У Натрію чотири енергетичних рівня.
10.(Л) Калій більш активніший метал ніж Літій.
11. (Р) Схема будови електронних оболонок Хлору має вигляд: 2,8.6.
12. (Є) До лужних металів належіть: Натрій, Калій , Літій, Цезій.
13. (Р) Карбон є більш сильнішим неметалом ніж Нітроген.
14. (Є) Флуор, Хлор, Бром, Йод – галогени.
15. (В) На другому енергетичному рівні немає d-підрівня.
Отримане слово «Менделєєв»
«Відгадай задуманий елемент»
З метою розвинути інтерес і звернути ще раз увагу на періодичну систему Д. І. Менделєєва. Для проведення гри знадобиться Періодична система Д. І. Менделєєва і калькулятори. Підчас гри ведучий просить одного з учнів задумати будь-який хімічний елемент періодичної системи. Після цього ведучий пропонує провести з номером цього елемента наступні обчислення (без повідомлення проміжних результатів):
1) номер елемента подвоїти;
2) до твору додати 5;
3) суму помножити на 5.
Останній результат повідомляється ведучому, який негайно оголошує елемент, задуманий граючим.
Розгадка полягає в наступному. Нехай задуманий елемент № 13 (Алюміній). Проведемо з числом 13 відповідні математичні дії:
13 • 2 = 26; 26 + 5 = 31; 31 • 5 = 155.
155 -число повідомляється ведучому, який в розумі відкидає останню цифру (виходить15) і віднімає від отриманого числа число 2 (виходить13). Це і є номер задуманого елемента. Після цього ведучому залишається тільки назвати цей елемент - Алюміній.
«Відгадай слово»
Визначте, в головних підгрупах яких груп періодичної системи знаходяться хімічні елементи, електронні схеми атомів яких наведені в першому стовпчику таблиці букви відповідні правильних відповідей дадуть назви елементарної частинки (таблиця 2.4).
Таблиця 2.4
|
Електронні схеми |
Групи |
||||
|
I |
II |
IV |
V |
VII |
|
|
2;4 |
Щ |
Ж |
Н |
Я |
Ю |
|
2;8;2 |
К |
Е |
М |
Н |
О |
|
2;1 |
Й |
З |
Ч |
Х |
Ц |
|
2;8;5 |
Д |
Г |
Н |
Т |
С |
|
2;8;18;8;1 |
Р |
У |
В |
Н |
А |
|
2;8;7 |
П |
И |
П |
С |
О |
|
2;8;18;4 |
Е |
И |
Н |
Т |
Ш |
«Відгадай задумане»
Гру проводять з метою розвинути в учнів уміння визначати за влучним висловом хімічний елемент або просту речовину. Потрібні картки з характерними рисами. Наприклад:
Картка №1
1. Елемент зі змінною валентністю.
2. Вищий оксид має кислотні властивості.
3. Елемент утворює кілька алотропних модифікацій.
4. Реакція з киснем широко використовується в промисловості і побуті.
5. Найважливіша сполука елемента використовується на всіх уроках.
6. Оксиди відіграють особливу роль в екології навколишнього середовища.
7. Входить до складу всіх живих організмів.
(Вуглець)
Картка № 2
1. Елемент утворює просту речовину, що добре проводить електричний струм.
2. У вільному вигляді не реагує з концентрованою сірчаною кислотою.
3. Гідроксиди елемента нерозчинні в воді.
4. Знаходить дуже широке використання, його виробляють з давніх часів.
5. При нагріванні взаємодіє з водяною парою.
6. Сполука елемента входить до складу крові людини і тварин.
7. В особливо чистому вигляді не схильний до корозії.
8. Одна із сполук називається піритом.
(Залізо)
Тема: «Основні класи неорганічних сполук»
«Третій зайвий»
При вивченні теми «Кислоти. Класифікація кислот. Властивості». актуалізацію опорних знань можна розпочати з ігри: знайти третього зайвого і літеру, під якою він знаходиться і отримаєте закодоване слово (в кожному рядку необхідно знайти зайву сполуку під літерою в якій вона знаходиться і з цих літер скласти закодоване слово):
1. к) Al(OH)3, о) HCl,, а) H2SO4
2. о) HNO3; и) H2O, в)H3PO4.
3. м) H2CO3; с) HCl; у) H2SO4;
4. д) HI; н) HF; л) H2SiO3;
5. о) H2O2 т) H2SO3; п) HNO3;
6. л) H2SO4 ; а) HCl; т) CuCl2.
7. е) Mg в) Fe и) S
Отже одержали слово «кислоти».
«Бігунок»
Дану гру можна використати з метою розвинення уваги, пам’яті та закріплення знань про основні класи неорганічних сполук. Для гри потрібний м’ячі невеликого розміру за кількістю команд. Гравці шикуються один за іншим в один ряд. Учень, який стоїть перший, тримаючи в руці м'яч, по команді, наприклад «Кислота» посилає м'яч гравцеві, що стоїть за ним, називаючи при цьому формулу кислоти. Консультант стежить за правильністю назви формул і щоб уникнути повторів. Команди можуть стосуватися будь-якого класу неорганічних сполук.
«Ромашка»
Га проводиться з метою розвинути уяву, інтуїцію, спостережливість і оцінити увагу учнів. Для проведення гри потрібні картки-пелюстки з формулами речовин, з яких слід скласти рівняння реакції (рисунок 2.2):
Завдання: Зібрати пелюстки, що розлетілися так, щоб вийшла запис рівняння реакції між гідроксидом натрію і сульфатною кислотою:
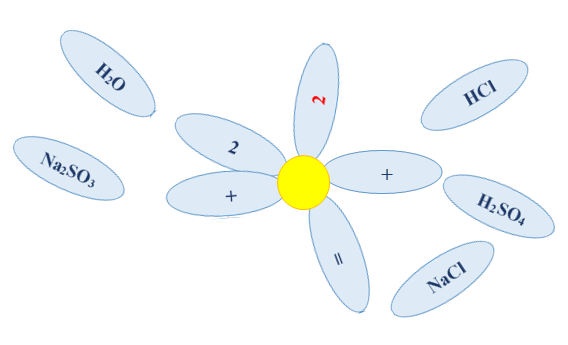
Рис.2.2 – «Ромашка»
«Пасьянс»
На столі у учнів картки, з яких потрібно скласти формули кислот, наприклад(рисунок2.3):




Рис.2.3 – «Пасьянс»
Дану гру можна використати для складання формул солей, основ.
« Дешифрування»
Учні отримали СМС – повідомлення, які потрібно розшифрувати (рисунок2.4):
чисельник - цифра, під якою літера знаходиться на кнопці мобільного телефону,
знаменник – порядковий номер літери на кнопці:
СМС : 5/1, 4/1, 7/1 ,5/2, 6/1, 7/2, 4/1
В повідомленні 2 зашифровано явище існування кількох простих речовин у одного хімічного елемента.

Рис. 2.4 –«Дешифрування»
СМС: 156766640
«Знайди пару»
Дану гру ще називають «Розірвана шпаргалка».
Сполучити лінією поняття « речовина – назва речовини» (рисунок 2.5).
|
BaSO4 |
|
Барій сульфат |
|
CO2 |
|
Карбон (IV) оксид |
|
Fe(OH)3 |
|
Ферум (ІІІ) гідроксид |
|
P2O5 |
|
Фосфор (V) оксид |
|
CaCl2 |
|
Кальцій хлорид |
|
Cu(NO3)2 |
|
Купрум (ІІ) нітрат |
|
LiOH |
|
Літій гідроксид |
|
SO3 |
|
Сульфур (VІ) оксид |
|
HNO3 |
|
Нітратна кислота |
|
SO2 |
|
Сульфур (ІV)оксид |
Рис.2.5 – «Розірвана шпаргалка»
«Естафета розрахункових формул».
Гра проводиться з метою удосконалювати пам'ять, увагу і закріпити вміння учнів записувати фізичні та математичні формули, за якими ведеться розрахунки при вирішенні завдань з хімії. При проведенні гри знадобиться кілька паперових листочків, складених віялом по числу граючих команд. На звороті кожної сторінки віяла написано назву фізичної або хімічної величини (бажано уникати повтору на одному аркуші). Кожна команда (можна по числу рядів в класі) отримує листочок віяло. За сигналом гравці, які сидять за першою партою, розкривають першу сторінку віяла і навпаки зазначеної величини пишуть формулу, за допомогою якої дана величина може бути знайдена або розрахована, і передають віяло на наступну парту. Якщо величина постійна, то вказують її значення.
«Хімічне печиво»
Учням пропонується у порожні комірки таблиць записати формули відповідних солей (таблиця 2.5).
Таблиця 2.5
|
Метал Кислота |
K |
Ca |
Fe(III) |
|
HCl |
|||
|
H2SO4 |
|||
|
H3PO4 |
« Так – ні» або «Віриш – не віриш»:
На етапі актуалізації знань або закріплення та узагальнення знань з теми «Кисень» доцільно використати дану гру. В грі приймають участь двоє учнів, які ставлять один одному підготовлені запитання заздалегідь. Кожне питання починається фразою:
Чи вірити ви, що…
1. … відносна атомна маса Оксигену – 32? (Ні)
2. …до складу води входить кисень? (Ні)
3. … риби дихають киснем розчиненим у воді? (Так)
4. …в повітрі за об’ємом 21% кисню? ( Так)
5. …молекула кисню одноатомна? ( Ні)
6. …кисень у повітрі існує у вільному стані? ( Так)
7. …Оксиген утворює просту речовину кисень? ( Так)
8. …відносна молекулярна маса кисню – 32? ( Так)
9. … Оксиген – найпоширеніший елемент на планеті Земля? ( Так)
10. …валентність Оксигену в сполуках дорівнює 2? ( Так)
При закріпленні типів реакцій відпрацювати поняття реакцій розкладу , сполучення, заміщення та обміну допоможе наступна картка (таблиця 2.6):
Таблиця 2.6
|
Характеристика |
Реакція розкладу |
Реакція сполучення |
|
Продукт - одна речовина |
1 |
2 |
|
Реагент- одна речовина |
3 |
4 |
|
Продукти – кілька речовин |
5 |
6 |
|
Кілька реагентів |
7 |
8 |
При правильній відповіді отримаєте суму чисел, яка дорівнює відносній молекулярній масі води.
Наступна вправа: з букв, відповідних правильних відповідей, ви отримаєте назви хімічних елементів (таблиця 2.7).
Таблиця 2.7
|
Рівняння реакції |
Реакція сполучення |
Реакція розкладу |
Реакція заміщення |
|
Mg + 2HCl = MgCl2 + H2 |
Ц |
Ч |
К |
|
2Na + S = Na2S |
А |
Е |
Ю |
|
MgCO3 = MgO + CO2 |
Т |
Р |
К |
|
N2 + 3H2 = 2NH3 |
Б |
Ч |
Х |
|
2Al (OH)3 = Al2O3 + 3H2O |
В |
О |
А |
|
Fe + CuCl2 = FeCl2 + Cu |
Д |
І |
Н |
«Ланцюжок»
Проводиться з метою активізувати мислення учнів, навчити прораховувати потрібні варіанти вирішення і краще орієнтуватися в періодичній системі.
Завдання: учні в класі діляться на команди (краще за варіантами). Учні за першими столами по команді ведучого пишуть на аркуші назва хімічного елемента і передають листок учням за другими столами. Ті повинні написати поруч назву іншого елемента, який починається на букву, якою закінчується перша назва, і так далі. Перемагає команда, що склала найбільш довгий ланцюжок - чайнворд.
Приклад. Цинк - Купрум - Манган – Неон - Натрій - Іод - Діспрозій
«Хрестики-нулики»
Рис.2.5 – «Хрестики-нулики»
«Хімічна казка». Дивовижне перетворення
Йшов по вулиці Метан. І раптом серед білого дня на нього накинувся грабіжник на прізвисько Хлор. Між ними зав'язалася бійка, в результате якої відірвали вони один у одного по одному атому. Лужний Натрій побачив бійку, коли проходив повз, і зопалу схватив потерпілого, та так міцно, що у того в очах роздвоїлося. А грабіжника і слід зник. Запитав Натрій ім'я у потерпілого, а той відповів: «Етан». Чому змінив ім'я потерпілий? Дайте відповідь за допомогою рівнянь хімічних реакцій.
Відповідь:
+Cl2 +Na
СH4 ![]() CH3Cl
CH3Cl ![]() C2H6
C2H6
метан хлорометан етан
1. СH4 + Cl2 → CH3Cl + HCl
2. 2CH3Cl + 2 Na → C2H6 + 2 NaCl
«Влуч у ціль» Поводять з метою розвинути логічне мислення, вміння систематизувати знання про властивості речовин. Визначити формули речовин і розстановити коефіцієнти (рисунок 2.6):
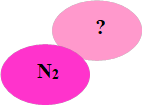



Рис.2.6 – «Влуч у ціль»
У трьох пов’язаних гуртках представлені неповні записи рівнянь хімічних реакцій, визначте формули відповідних речовин з необхідними індексами і коефіцієнтами.
«Кросворди, чайнворди, ребуси».
Цей вид завдань як і раніше досить часто використовується на уроках хімії. Кросворди (творчі форми перевірки засвоєння фактичного матеріалу) допомагають пожвавити опитування і активізувати роботу учнів на уроках хімії.
Кросворд може бути запропонований на початку уроку з метою актуалізації знань або постановки проблеми нового уроку. Кросворд, запропонований в кінці уроку, може стати своєрідним підбиттям підсумків роботи на уроці. Незамінні кросворди, чайнворди і інші головоломки в тих випадках, коли дітям потрібно дати своєрідну хвилинку відпочинку: перемикання уваги, можливість подивитися на явища мови під іншим кутом зору - хороша можливість підтримати розумову активність учнів на уроці.
Крім цього, кросворди можуть стати формою контролю на будь-якому етапі навчання. У цьому випадку він може бути не тільки запропонований учням в готовому вигляді, але також і самі учні можуть скласти кросворд з досліджуваної (вивченої) теми (рисунок 2.7).
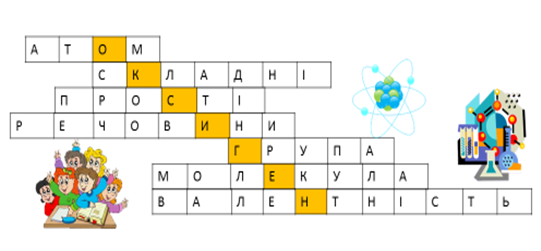
Рис.2.7 – Кросворд «Оксиген»
Завдання:
1.Дрібна хімічно неподільна частинка речовини.
2.Речовини, що складаються з двох і більше елементів.
3. Речовини, що складаються з атомів одного елемента.
4. Що вивчає хімія?
5. Вертикальний стовпчик елементів.
6. Найменша частинка речовини, що зберігає її властивості.
7. Здатність атома одного елемента приєднувати певну кількість атомів іншого хімічного елемента.
Для перевірки засвоєння поняття «амфотерності» учням пропонують заповнити порожні клітки в кросвордах на дошці (рисунок 2.8):
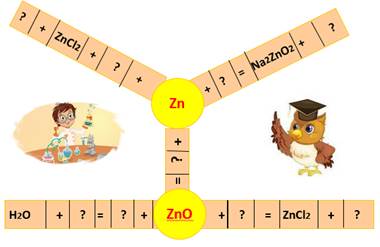
Рис.2.8 – Кросворд «Амфотерність»
Перевіривши правильність написання рівнянь в кросвордах, учні демонструють хімічні реакції, характерні для гідроксидів цинку і алюмінію, попередньо отримавши їх.
Ребуси – це загадки - малюнки, в яких замасковано слово, яке слід розгадати (рисунок 2.9) [5].



Рис.2.9 - Ребуси
2.2 Розробки уроку із застосуванням дидактичних ігор
Урок з теми « Узагальнення та систематизація знань з теми «Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома» (Слайд 1)
Мета:
- повторити і узагальнити основні поняття з теми, закріпити вміння за електронною формулою атома визначати хімічний символ елементу, положення його в ПСХЕМ, закріпити навички розв’язування вправ;
- вдосконалювати вміння аналізувати, порівнювати, узагальнювати, встановлювати причинно-наслідкові зв'язки, робити висновки, застосовувати теоретичні знання для прогнозування;
- стимулювати пізнавальну активність учнів, інтерес до предмету;
- сприяти формуванню предметних компетентностей, навичок самоконтролю, вміння творчого застосування своїх знань;
- розвиток наполегливості та працелюбності, здатності обирати оптимальні рішення, співпраці в групі.
Обладнання: періодична система хімічних елементів Д.І. Менделєєва, довідкові матеріали, , картки із завданнями.
Тип уроку: урок узагальнення, систематизації та корекції знань.
Методи, прийоми роботи: практичні – розв’язування вправ, задач; інтерактивні: робота групах, самоконтроль, взаємоперевірка.
Наочність і ТЗН : мультимедійний проектор, презентація засобами МS Роwег Роіnt, магнітна дошка.
Форма проведення:урок з використанням дидактичних ігор.
Хід уроку
І. Організаційний етап
Доброго дня! Діти, упродовж кількох тижнів ми з вами наполегливо працювали над вивченням теми «Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома». Девізом нашого уроку стануть такі слова: «Хімія – велика наука і кожен може застосувати в ній свій талант»(Слайд 2).
Знову дзвінок покликав у клас,
Сьогодні хімія у вас.
Цікава подорож чекає,
Країна « Елементів » двері відкриває.
Вас прошу не зівати,
Міцні знання там здобувати.
ІІ. Повідомлення теми і мети уроку
Тема нашого уроку: «Узагальнення та систематизація знань з теми «Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома»». Мета – закріпити знання про періодичний закон, періодичну систему хімічних елементів Д.І. Менделєєва та будову атома. На цьому уроці ми повторимо основні теоретичні положення, а також удосконалимо вміння складати електронні формули визначати хімічний елемент за його характеристиками.
Працювати сьогодні ми будемо в командах, які будуть змагатись між собою, але отримувати бали за правильні відповіді та активність. Для ефективної роботи в команді треба вибрати капітана та секретаря, який буде фіксувати отримані бали за виконання завдань та слідкувати за їх розподілом.
А зараз закрийте очі і подумки повторюйте за мною: "Я уважний, я добре думаю, я зосереджений, кмітливий, впевнений у собі." Відкрийте очі та погляньте на свого однокласника, усміхніться йому. У такому гарному настрої спробуємо працювати швидко і творчо, щоб отримати найвищі бали.
ІІІ. Мотивація навчальної діяльності.
Природа має лише один секрет:
чи тут, чи там, у космосу глибинах.
Все: від малих піщинок до планет –
із елементів складене єдиних.
С. Щипачов «Читаючи Менделєєва» [6].
Як ви розумієте значення цих слів? Що нам дає знання періодичного закону? Як практично його можна використовувати? (учні відповідають)
Таблиця Менделєєва – це таблиця історії та життя світобудови. Вивчаючи її ми постійно дізнаємося, що хімічні елементи, так поетично описані літераторами, – це цеглинки світобудови, з яких складається наш Всесвіт. І вивчаючи періодичний закон і хімічні елементи, людина ще пізнає багато цікавого, зробить масу необхідних людству відкриттів. «Періодичний закон є істинним компасом для дослідників» (В. Рамзай, шотландський хімік) [7].Дійсно, таблиця Менделєєва - це наш путівник по країні хімії, наш рятівник у «хімічно складних» ситуаціях. Тільки потрібно зуміти побачити все, що в ній написано і не написано, треба вміти читати між рядків. Сьогодні наступні 40 хвилин ми з вами проведемо разом біля таблиці Д.І. Менделєєва.
IV. Актуалізація опорних знань
1. Розминка: «Хто швидше?»
1.Коли, хто і на основі чого сформулював періодичний закон і склав періодичну систему хімічних елементів? (Менделєєв, 1869, атомні маси).
2.Чому закон був названий періодичним? (Тому що властивості хімічних елементів та їх сполук повторювались через певний період).
3. Яка структура періодичної системи? (Таблиця).
4. З чого складається атом? (З позитивно зарядженого ядра і негативно заряджених електронів, що рухаються навколо нього).
5. Які відомості про будову атома дають порядковий номер, номер періоду, номер групи? (Заряд ядра, кількість протонів, електронів; кількість енергетичних рівнів; кількість електронів на зовнішньому енергетичному рівні).
6. Що спільного в атомах елементів одного періоду? (Число енергетичних рівнів).
7. Що спільного в атомах елементів однієї групи? (Число електронів на зовнішньому енергетичному рівні для головних підгруп).
8. Який електронний вважається завершеним? (Коли містить 8 електронів).
9. Як за періодичною системою визначити валентність елементів? (За номером групи).
10. Скільки хімічних елементів було відомо на момент відкриття періодичного закону? (63 хімічні елементи).
11. Існування скількох хімічних елементів передбачав Менделєєв? (11, екабор, екаалюміній , екасиліцій та ін.).
12. Поясніть поняття: малі й великі періоди? (Періоди, що складаються з одного ряду є малими, а з двох рядів – великими).
13. Назвіть природні родини хімічних елементів. (І – лужні метали, VII група – галогени, VIII група – інертні гази).
14. Які елементи обертаються навколо Сонця ? (Нg – меркурій, Те = телур (Земля), Рu – плутоній, Np – нептуній, U - уран).
15. Який елемент не має «постійної прописки» в таблиці? (Н).
16.На який хімічний елемент багата морська водорість – ламінарія («морська капуста»)? (Йод – І, необхідний для щитовидної залози).
17.Який елемент має більш виражені металічні властивості Кальцій чи Ферум? Чому? (Кальцій).
18. Назвіть загальні формулу вищих оксидів елементів V групи. (R2O5).
Звичайно, вклад Д.І. Менделєєва в розвиток хімії величезний, але він працював над проблемою класифікації елементів не один. І до нього, і після нього були зроблені відкриття, що дозволили розкрити сутність закону і підтвердити ті дані, які Менделєєв міг лише передбачати.
2. Учені-хіміки та їх відкриття (на екран висвічуються портрети учених (Слайд 3).
1. Один з них обчислив швидкість електрона і його масу (300 тис. км/с, в 2 тис. разів легше за водень), його модель атома має назву «кекс, булочка з родзинками». (Джозеф Томсон).
2. Ці двоє французьких учених досліджували явище радіоактивності. Відкрили хімічні елементи – Полоній, Радій (П’єр Кюрі і Марія Склодовська-Кюрі).
3. До цих пір використовується модель атома, запропонована в 1911г. Який учений її запропонував? (Ернест Резерфорд).
4. Англійський вчений, який встановив, що порядковий номер елемента збігається з зарядом ядра атома. (Генрі Мозлі).
5. Датський фізик і хімік, який є основоположником квантової теорії будови атома? (Нільс Бор).
V. Застосування набутих знань
1. «Перетвори записи на формулу»
Командам пропонується на аркушах записи формул хімічних сполук без індексів. Необхідно швидко і правильно написати формули (кожен учасник команди пише одну формулу):
І команда ІІ команда
KO AlO RbO AsO
PO ClO CaO GaO
SiH HS NH TeO
HI BaO BrO HCl
SnO PbO MgO CH
2. «Конкурс «Математичний»
За даними формулами знайти хімічний елемент:
І команда: a2 – (b-c) = Nпор Е
a- кількість нейтронів в атомів Літію;
b - протонне число атома Фосфору;
c - загальна кількість електронів в атомів Карбону
Відповідь: Нітроген
ІІ команда: a + (b2 -c) = Nпор Е
a– протонне число Силіцію;
b– заряд ядра атома Бору;
c - загальна кількість електронів в атомів Оксигену
Відповідь: Галій.
3. «Розв’яжи задачу»
І команда:
Цей елемент надає зеленого кольору листкам, бо входить до складу хлорофілу і забезпечує усіх життєдайним киснем. У людському організмі виконує протизапальну та судинорозширювальну дію, бере участь у вуглеводневому та фосфатному обмінах. За його нестачі з’являються судомні напади, трофічні виразки, неспокій і страх. При надлишку – з’являється сонливість, уповільнення серцебиття, пригнічення дихання. Який це елемент? Відповісти на це запитання нам допоможе задача:
Масова частка двовалентного елемента в його оксиді дорівнює 60%. Знайдіть цей елемент? Записати для нього електронну схему, формулу і графічну формулу.
ІІ команда:
Я з металами стою,
Хоч м’який, мов масло.
Жовтим полум’ям горю,
Й довго не погасну.
Я поширений доволі:
В соді, склі, в кухонній солі.
Відносна молекулярна маса оксиду елемента І групи періодичної системи хімічних елементів дорівнює 62. Знайдіть цей елемент. Записати для нього електронну схему, формулу і графічну формулу.
4. «Розсипані словосполучення»
Таблиця 2.8
|
1. Таблиця |
А. Малий |
|
2. Підгрупа |
Б. Натрій |
|
3. Період |
В. Менделєєв |
|
4. Галоген |
Г. Аргон |
|
5. Лужний метал |
Д. Барій |
|
6. Лужноземельний метал |
Е. Титан |
|
7. Інертний газ |
Є. Головна |
|
8. d- елемент 4 періоду |
Ж. Арґентум |
|
9. р- елемент VI групи |
З. Хлор |
|
10.Благородний метал |
И. Телур |
Відповіді: в,є,а,з,б,д,г,е,и,ж
5. «Хімічний лабіринт»
І команда : Виграшний шлях - метали

Рис.2.10 – Лабіринт для І команди
ІІ команда: Виграшний шлях – неметали.

Рис.2.11 – Лабіринт для ІІ команди
6. «Впізнай мене»: (Карусель)
1. Я, металічний елемент, знаходжусь в першій групі, головній підгрупі, маю 11 протонів і 12 нейтронів.(Натрій)
2. Я, знаходжусь в побічній підгрупі 8 групи, утворюю просту речовину залізо, маю 26 електронів. (Ферум)
3. Я, галоген, відносна молекулярна маса мого вищого оксиду = 150.(Флуор)
4. Я, лужний метал, маю 2 електроні шари. (Літій)
7. « Сюрприз »
Учасникам потрібно відгадати загадки(слайди 4-7) (таблиця 2.9).
Таблиця 2.9
|
Струму добрий провідник, В світі третій мандрівник З букви «А» я починаюсь, Срібно-білий я й згинаюсь. А іще зовусь «крилатим» — Спробуй мене відгадати.
|
Із благородних він металів, Про нього деякі деталі: На нього дивишся, а себе бачиш, Коли смієшся ти чи гірко плачеш, Шукаєш в ньому вроди і краси. Коли ж у воду трохи добавиш — Цілющою проста вода стає, Людині сили і здоров'я додає.
|
|
Цей елемент дві назви має. Одна із них планету називає, За другою ми звемо солі і сполуки, У нього є проста речовина, Та краще нам її не брати в руки. В приміщенні, де проживають люди, Від неї всім лиш горе буде. Так легко нам її розлити — Важче знешкодити й зловити.
|
Даю алмаз, даю графіт, Базальти, гіпси і граніт; Природний газ і нафту, й сажу, Ще й різні мінерали зразу Метал важкий, і тим прекрасний, Його рентгеном не візьмеш . Проміння вміє поглинати, Людям здоров’я захищати.
|
|
Даю алмаз, даю графіт, Базальти, гіпси і граніт; Природний газ і нафту, й сажу, Ще й різні мінерали зразу Метал важкий, і тим прекрасний, Його рентгеном не візьмеш . Проміння вміє поглинати, Людям здоров’я захищати.
|
В живих клітинах і глибинах Життя дає гемоглобіну. Хоча і мужній цей метал , Але в побічній групі сам. Та особливу гордість має Із нього ж сталь видобувають !
|
|
Я рослинам необхідний І для ґрунту завжди рідний. Кольоровий у природі. Білий в чорний переходить, Ти червоний фосфор стрів, На коробках сірників! І в твоєму мозку є , …. – це ім'я моє. |
В повітрі головний він газ, Й оточує повсюди нас. Він в клітинах ніби ген Цей важливий … [8].
|
8. «Хто швидше?»
Скласти назви елементів з букв:
І команда: Б,О,Л,Д,М,С,Х,Р,Й (Br, Cl, I, Cr, B)
ІІ команда: І,Л,А,Р,Т,У,Б,Д,Й,Н ( Li, Na, Rb,)
9. «Перекладачі» Перекласти з хімічної мови українською.
Не все Аурум, що блищить.
Білий , як кальцій карбонат.
Ферумний характер.
Слово – Арґентум, а мовчання – Аурум.
За купрумний гріш повісився.
Багато Н2О витекло.
10. Кросворд «Періодичний закон і періодична система хімічних елементів Д. І. Менделєєва»
Розгадайте кросворд і у виділеному вертикальному рядку отримаєте ключове слово – назву елементарної частинки (Слайд 8).
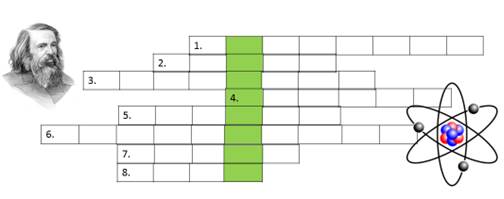
Рис.2.12 - Кросворд
1. Один з елементів, властивості якого були передбачені Менделєєвим.
2. Легкий та безпечний газ для наповнення повітряних кульок.
3. Один з ізотопів Гідрогену.
4. Елемент з електронною формулою 1s²2s²2p².
5. Хімічний елемент, що дав назву 14 «близнюкам» № 58 – 71.
6. Інша назва інертних газів.
7. Найактивніший неметал.
8. Ім’я батька Менделєєва.
Сьогодні ми пригадали будову періодичної системи, узагальнили свої знання, дізналися про корисні властивості речовин, що утворюють деякі елементи. Чи погоджуєтеся ви зі словами Д.І. Менделєєва: «Періодичному закону майбутнє не загрожує руйнуванням, а тільки надбудову й розвиток обіцяє» (Д. І. Менделєєв).
IV. Домашнє завдання. Знайти вірші або вислови відомих людей про значення періодичного закону.
V. Підбиття підсумків уроку (слайд 9-10)
Коментоване оцінювання роботи учнів.
7 серпня 1887 року повітряна куля, наповнена воднем, піднялася над хмарами на висоту більше трьох кілометрів.У корзині кулі знаходився пілот і одночасно дослідник, який спостерігав сонячнезатемнення і перевіряв роботу чисельних приладів, в тому числі барометра його власної конструкції. Барометр дозволяв швидко визначити відстань від кулі до Землі по величині атмосферного тиску.Гнана вітром, куля пролетіла понад 100 км. Сміливому пілоту-досліднику і єдиному учасникові цього вдалого, на щастя,польоту було 53 роки. Його звали Д.І. Менделєєв.
Нелегкий тягар всесвітньої слави творця періодичного закону, який він відкрив у 1869 році, ніскільки не вплинув на невпинне і мужнє прагнення до пізнання невідомого, що все життя володіло великим хіміком. І вам я бажаю жадання пізнання, безпомилкової інтуїції, хай кожен вибере правильно свою стежку, свою дорогу, свою науку.
Спасибі за співпрацю та гарні відповіді.
Хочу завершити урок рядками з віршу :
Які чудові відкриття
Учені нам дарують
Та геній Менделєєва,
Ніколи не забудуть!
Він – компас для наук,
Що в темряві блукали.
Відкритий ним закон
У світі привітали.
2.3. Навчальна гра «Інтелект – мій вибір!»
Інтелектуальна гра з мультимедійним супроводом для учнів 10-11 класів
Будьте самі шукачами, дослідниками.
Не буде вогника у вас – вам ніколи
не запалити його в інших.
Василь Сухомлинський
Важлива особливість інтелектуальних ігор полягає в тому, що вони спонукають до роботи думки, будять допитливість, мають неабиякий вплив на оптимістичне світовідчуття.
Мета. Активізувати пізнавальну діяльність учнів як необхідна умова розвитку інтелектуальних і творчих здібностей.
Завдання:
1) розширити і поглибити знання учнів з предмета;
2) продовжити розвиток комунікативних умінь (підготовка публічного виступу, участь у колективній діяльності);
3) сприяти підвищенню творчої активності учнів;
4) продемонструвати необхідність хімічних знань у повсякденному житті.
Примітка. У грі беруть участь команди учнів 10 класів. Чисельність команди не повинна перевищувати 7-9 чоловік.
Основні правила: в грі десять турів. Кожен тур не пов'язаний з іншими і тому вчитель заздалегідь може продумати хід гри, навіть виключаючи будь-які тури ( або додати) з гри через брак часу.
Управління презентацією. Другий слайд презентації (головна сторінка) містить необхідну інформацію про турах. При наведенні курсора миші на потрібний тур, необхідно перейти за гіперпосиланням безпосередньо до завдання. Після відповіді гравців на питання чи ряд питань, необхідно повернутися на головну сторінку для того, щоб приступити до гри в наступному турі.
Хід гри.
Вступом служать слова Ломоносова, розташовані на першому слайді презентації «Скрізь досліджуйте повсякчас, що є велике і прекрасно, чого ще не бачив світ». Далі 1 ВЕДУЧИЙ запрошує команди зайняти свої ігрові місця.
1 тур. Розминка.
Слайди № 3-7.Кожній команді задаються питання.
«Блеф - гра». Чи вірите ви, що ... З головного слайда за гіперпосиланням перейти на слайд № 3 і почати зі слова розминка.
1. Нітратну кислоту називають «царською горілкою»? Відповідь. Ні
2. Синтетичні полімери називають безсмертними жителями Землі? Відповідь. Так. Для них не перебуває відповідних редуцентов, тому вони майже не включаються в кругообіг речовин.
3. У 19 столітті в Петербурзькій Академії наук обговорювалася можливість називати соляну кислоту воднем хлоровічем, воду - воднем кіслородовічем? Відповідь. Так.
4. Жир, яким заповнений герб верблюда, служить в першу чергу не джерелом енергії, а джерелом води? Відповідь. Так.
Гравці записують свої відповіді в спеціальний лист, який їм роздають помічники ведучого перед кожним туром. Лист з відповідями передають в журі, саме воно вирішує, чи слідувати далі. Повернутися на посилання "Правильні» і ВІДПОВІДІ навести мишку на указку-Палець, щоб дізнатися правильні відповіді.
2 тур. Хрестики - нулики.
Слайди № 8-25. У грі беруть участь всі команди. Накреслене ігрове поле заповнюється по ходу гри. На кожне питання можна відповідати тільки «Так» або «Ні». Лист-звіт отримує кожна команда окремо для того, щоб заповнити по ходу гри і в кінці передати журі (Додаток 2).
1 питання. Аргентина названа в честь срібла? Відповідь. Так.
2 питання. Платину називали «гниле золото», «жаб'яче золото», серебрішко»? Відповідь. Так.
3 питання. Ейфелева вежа, «залізна пані», як її часто називають в Парижі, влітку на 15 см вище, ніж взимку. Відповідь. Так.
4 питання. Перший історично відомий паспорт був бронзовий? Відповідь. Так.
5 питання. Англійський король Генріх VIII отримав у своїх підданих прізвисько «старий мідний ніс» тому, що зловживав алкоголем і його ніс мав синьо-зеленуватий відтінок? Відповідь. Ні. Генріх VIII підробляв монети, покриваючи мідні шаром срібла. На монеті був зображений його профіль. Ніс - сама виступає частина монети - ставала мідної за рахунок стирання тонкого шару срібла.
6 питання. Гривня - це злиток срібла масою 200 г. Якщо цей злиток рубали навпіл, то отримували гривеники? Відповідь. Ні, рублі.
7 питання. Здійснення листів під час воєн здійснювалася за допомогою ядра? Відповідь. Так.
8 питання. На завод, що випускає леза для бритв, що працюють там чоловіки повинні приходити неголеними для перевірки якості лез? Відповідь. Так, такий завод є в Польщі.
9 питання. Існувала дорога, вимощена «бруківкою зі срібла»? Відповідь. Так, віце-король Іспанії приїхав в Перу, і тутешні вельможі, щоб не вдарити обличчям в бруд, виклали дорогу в Лімі від тріумфальної арки до палацу сріблом. Після того, як гість пройшов, дорогу відразу демонтувати і піднесли йому в дар.
10 питання. Занепад і розпад Римської імперії (на думку деяких вчених) були обумовлені отруєнням свинцем. Відповідь. Так.
11 питання. Колись в моді було писати запрошення або визнання в любові на пелюстках квітів. Писали розчином кислоти або лугу, користуючись тонким пером або паличкою? Відповідь. Так.
12 питання. Зазвичай картопля в воді тоне, але при додаванні насиченого розчину солі бульба спливає? Відповідь. Так, звичайно картопля в воді тоне, але при додаванні насиченого розчину солі, питома вага якого вище питомої ваги картоплі, бульба спливає.
13 питання. При розчиненні шматка цукру-рафінаду в склянці з чаєм швидкість розчинення не зміниться, якщо ... накрити склянку кришкою? Відповідь. Так, не зміниться.
14 питання. Здатність деяких речовин ( «сухого льоду», йоду, нафталіну) переходити при нагріванні з твердого стану в газоподібний, оминаючи рідкий, ... сублімація називається? Відповідь. Так.
15 питання. Хімічна будова речовини відображають архітектурні, а не структурні формули? Відповідь. Ні.
16 питання. Товщина людської волосини приблизно становить 80 мікрон (або мікрометрів). Створювана металургами золота фольга більш ніж в 300 разів тонші людської волосини? Відповідь. Так.
2 тур. Підведення підсумків. Журі підводить підсумки. Під час підведення підсумків звучить музична пауза.
3 тур. Чорна скриня.
Слайди № 26-32. На даному слайді розташовані шість «чорних скринь». Цей етап гри вчитель може організувати таким чином: кожен ящик дістається тільки одній команді, і тоді інші учасники чекатимуть своєї черги в грі, або все команди отримують однакове завдання одночасно, і оцінюється в цьому випадку швидкість виконання завдання і його правильність. Відповіді вписати в додаток №2.
1 ящик. Завдання: у перекладі з грецької означає непохитний, твердий. За фізичними властивостями кристалічна речовина, тугоплавка, не проводиться електричний струм. Кристали можуть бути безбарвні прозорі та прозорі красивого синього, зеленого, червонуватого, чорного кольору. Цією речовиною перський уряд, щоб «уласкавити білого царя», розплатився за кров відомого російського дипломата і видатного письменника О. С. Грибоєдова, полеглого від рук розлюченого натовпу у 1829р. в Тегерані.
Відповідь: Алмаз, атомна кристалічна ґратка.
2 ящик. Завдання: альпіністи та туристи які збираються здійснити подорож по горах, повинні знати, що намет треба встановлювати так, щоб вхід до нього був обернений до підніжжя гори. Для чого це потрібно робити?
Відповідь: Це необхідно для вільного «витікання» вуглекислого газу. Якщо все зробити навпаки, тоді намет швидко наповниться вуглекислим газом і люди під час сну можуть задихнутись).
3 ящик. Завдання: Наполеон ІІІ на банкеті видавав особливо почесним гостям цей посуд. Гості простіше удостоювалися звичайними золотими і срібними приборами. А зараз її називають посудом бідняків. Що це за посуд?
Відповідь: алюмінієвий посуд називають посудом бідняків, так як цей метал сприяє розвитку старечого атеросклерозу. При приготуванні їжі в такому посуді алюміній частково переходить в організм, де і накопичується. А в 19 столітті на імператорських прийомах алюмінієвий посуд була найпрестижнішою. До того ж, тільки у сина Наполеона III була дуже дорога на ті часи алюмінієва іграшка. У чорному ящику №3 знаходиться алюмінієвий посуд: ложка, виделка і ін.
4 ящик. Завдання: гарними в Стародавньому Єгипті вважалися жирне волосся, тому єгиптяни рясно змащували їх жиром. У дні похорону прийнято було посипати голову золою. Одного разу під час похорону пішов дощ, і в цей момент, як свідчить історія, відбулася подія, яка відіграла значну роль в житті людства. Воно залишається важливим для нас і зараз. Що ж сталося?
Відповідь: голови вкрилися піною - відкриття мила. У чорному ящику № 4 мило.
5 ящик. Завдання: в ящику та речовина, яка пов’язана з ім’ям М.В. Ломоносова:
«Не про ті речі
Думає Шувалов.
Що тут цінніше за мінерали?
Не сріблу і золоту
Співаю я славу, а …» Чому?
Відповідь: Скло. «Лист про користь скла» Ломоносов «адресував» Шувалову. Незважаючи на те, що Шувалов належав до його безоглядних шанувальників, а може, саме тому, Ломоносов починає «Лист» випадами проти тих, хто іронізував над його захопленням, а то й відкрито перешкоджав поширенню скляних мануфактур у Росії:
Неправо о вещах те думают, Шувалов,
Которые стекло чтут ниже минералов,
Приманчивым лучом блистающих в глаза:
Не меньше польза в нем, не меньше в нем краса.
Читаючи «Лист про користь скла», спочатку просто втішаєшся чудовими віршами. Але потім розумієш, що це все-таки наукове дослідження, присвячене огляду різних галузей застосування скла.
6 ящик. Завдання: біла кристалічна речовина, тугоплавка, добре розчиняється у воді, розчин проводить електричний струм. Відсутність цієї речовини в раціоні наполеонівських солдатів під час їхнього відступу з Москви стало причиною різного збільшення смертності від поранень. У давні часи в Китаї з неї виготовлялись монети, на які ставилось клеймо богдихана.
Відповідь : кухонна сіль.
4 тур. «Ребуси»
Слайди № 60-67. «Ребуси». Команда, яка швидше знайде відповідь, отримує додатково 1 бал. Всього 8 ребусів. Відповіді оформлюються в додатку № 3.
1. Стійкій ізотоп найпоширенішого елементу Всесвіту(Дейтерій).
2. Перший контакт людини з цією речовиною відбувся ще у 3 тис до н.е. У волоссі знайденої мумії в альпійському льодовику виявлений значний вміст цього елементу (Миш’як).
3. Природний полімер, головна складова оболонки рослинних клітин (Целюлоза).
4. Відомий англійський алхімік Р.Бойль, щоб зрозуміти, як влаштований світ, провів тисячі дослідів. Ось один із них. У лабораторії горіли свічки, в ретортах щось кипіло, коли недоречно зайшов садівник. Він приніс кошик з фіалками. Бойль дуже любив квіти, але треба було почати дослід. Він взяв кілька квіток, понюхав і поклав їх на стіл. Дослід почався, відкрили колбу, з неї повалив їдкий пар. Коли ж дослід скінчився, Бойль випадково глянув на квіти, вони диміли. Щоб врятувати квіти, він опустив їх у склянку з водою. І - що за дива-фіалки, їх темно-фіолетові пелюстки, стали червоними. Випадковий досвід? Випадкова знахідка? Роберт Бойль не був би справжнім вченим, якби пройшов повз такого випадку. Учений зрозумів, що колір фіалок залежить від того, який розчин знаходиться в склянці, які речовини містяться в розчині. Потім Бойль зацікавився, що покажуть не фіалки, а інші рослини. Кращі результати дали досліди з лакмусовим лишайником. Тоді Бойль опустив в настій лакмусового лишайнику звичайні паперові смужки. Дочекався, коли вони просочяться настоєм, а потім висушив їх. Ці хитрі папірці Роберт Бойль назвав… (Індикатор).
5. Історія цієї речовини почалася майже двісті років тому, в далекому 1818 році, коли француз Луїс Тенаро, проводячи хімічні досліди з різними речовинами, вирішив поєднати пероксид барію і сірчану кислоту. Саме в результаті цієї хімічної реакції і було отримано речовину, дуже схожу на звичайну воду, але відрізнявся від води тим, що було в півтора рази важче, випаровувалося помітно повільніше і в будь-яких пропорціях могло розчинятися у звичайній воді. Нове речовина отримала назву «окислена вода» (Пероксид).
6. Лабораторна посудина грушоподібної форми з повернутим у бік носиком для перегонки й розкладання речовин нагріванням, виготовляється з вогнетривкого скла, фарфору або металу (Реторта).
7. Ця речовина зміцнює асфальт, також вона уповільнює застигання готового бетону і клею. Вона використовується при виготовленні чорнила і фарб для принтерів. У медицині вона використовується для вирощування пеніциліну, вона була однією з перших фармацевтичних інгредієнтів, які використовуються і сьогодні, щоб замаскувати гіркий смак ліків. Деякі люди вважають, що сухе ковтання 1 чайної ложки цієї речовини може вилікувати гикавку (Цукор).
8. Надзвичайно отруйне, небезпечна речовина, утворюється внаслідок неповного згоряння пального в автомобільних двигунах чи в опалювальни х приладах, які працюють на вугіллі або на інших видах природного палива (Чадний газ).
5 тур. Анаграми.
Слайди № 39-48. Перестановка букв. Позначає слово, утворене перестановкою букв. Всі команди отримують однакове завдання. Виграє та команда, яка швидше впорається із завданням ( Додаток 4 ).
Правильні відповіді:
І частина
1. Фтор – Торф 3. Радон – Народ
2. Бром – Ромб 4. Графіт – Граніт
ІІ частина
|
1 |
2 |
3 |
4 |
5 |
|
Сіль |
Основа |
Кислота |
Оксид |
Реакція |
|
Глюкоза |
Сахароза |
Крохмаль |
Фруктоза |
Гліцерин |
|
сполука |
заміщення |
розклад |
обмін |
нейтралізація |
6 тур. Вчися читати.
Слайди № 49-52. Прочитайте тут тему магістерської дисертації видатного російського хіміка Олександра Михайловича Бутлерова, захист якої відбувся в 1851 році.
Примітка. Є підказка під цифрами 1,2,3. При наведенні курсора миші з'являється підказка: 1 - початок пропозиції з великої літери; 2 - три лінії покажуть порядок з'єднання складів; 3 - інші лінії, змінюючи колір, покажуть з'єднання складів в пропозицію до кінця.
Відповідь. Починаючи з нижнього кружечка і слідуючи потім уздовж ліній, що з'єднують кружечки, можна прочитати: «Про окислення органічних сполук» - тему магістерської дисертації А. М. Бутлерова.
Слайди № 46-47. Перед Вами не гігантська формула невідомого речовини. Тут зашифровані слова М.В. Ломоносова про те, яким повинен бути справжній хімік (Додаток 5).
Відповідь. Щоб розшифрувати запис, потрібно в назві елемента вибрати по одній букві, відповідної індексу хімічного знаку. В результаті отримаємо слова великого вченого: «Істинний хімік повинен бути теоретиком і практиком».
7 тур. Дотепне рішення.
Слайди № 53-54. Завдання 1. В 1943 році видатний датський хімік лауреат Нобелівської премії Нільс Бор змушений був таємно покинути Копенгаген, окупований гітлерівцями. Але у нього зберігалися дві золоті медалі лауреатів Нобелівської премії - німецьких фізиків антифашистів Джеймса Франка і Макса фон Лауе. Не ризикуючи брати медалі з собою, вчений зробив дотепний крок …?
Варіанти відповіді:
1) покрив їх алюмінієвою фарбою;
2) розчинив в царській горілці;
3) покрив шаром шоколаду.
Відповідь: Н. Бор розчинив медалі в царській горілці і поставив нічим не примітне пляшку подалі на полицю, де припадала пилом багато таких же. Розрахунок виявився вірним, окупантів цікавили пляшки зі шнапсом, а не із сумнівним вмістом. Повернувшись після війни в свою лабораторію, Бор, перш за все, знайшов дорогоцінну пляшку; на його прохання співробітники виділили з розчину золото і заново виготовили обидві медалі.
Слайди № 55-56. Завдання 2. На Русі майстри ливарних справ вміли наполягти на тому, щоб замовники на лиття дзвонів поставляли їм в достатній кількості мідь, олово і срібло. Як їх використовували?
Відповідь: мідь і олово йшли на дзвони, а срібло погіршувало дзвін дзвонів, тому ливарники ділили його між собою.
Слайд № 57-58. Завдання 3. Нещодавно при спорудженні будівлі в Шотландії робочі виявили склад залізних цвяхів, зроблений майже два тисячоліття тому. У ті часи Британія була однією з окраїнних провінцій Римської імперії. На місці нинішньої будівництва стояла фортеця, споруджена римськими легіонерами. Забирати з собою цвяхі, що там зберігалися (сім тон) не мало сенсу, але і залишати їх теж не хотілося. Ось і вирішили зарити ящики глибше в землю до кращих часів. Але кращі часи так і не настали. А Цвяхи ...
Варіанти відповіді:
1) віддали італійському уряду в обмін на картину епохи Відродження;
2) використовували для відливання пам'ятника Юлію Цезарю;
3) запакувати в поліетиленові пакети і стали продавати туристам.
Відповідь: підприємливі будівельники упакували цвяхи в пакети і стали продавати їх туристам. При цьому із задоволенням спостерігали, як проржавіле залізо без всякого «філософського каменю» перетворюється в дзвінке золотце. І треба думати, вони не раз пом'янули добрим словом Юлія Цезаря, який затіяв похід на Британські острови.
Слайд № 59-60. Завдання 4. Перед шевцем-індійцем впав на землю предмет, схожий на цеглу. Старий вирішив помацати його, але обпікся. Чим виявився цегла?
Варіанти відповіді:
1. Уламком літака;
2. Уламком метеорита;
3. Шматком золота.
Відповідь: Старожили Бомбея до сих пір пам'ятають цей нещасливий день: о 16 год 6 хв в результаті пожежі вибухнув стояв в порту англійська вантажний пароплав, на борту якого перебувало понад півтори тисячі тон сильних вибухових речовин. Жахливий вибух підняв в повітря і розкидав на сотні метрів все, що знаходилося на палубах і в трюмах. Серед вантажів були 155 злитків золота по 22 кг кожен
8 тур. «Хімічні епітети».
Слайд № 61-64. На уроках української мови і літератури ви неодноразово чули, та й самі застосовували, епітети - засоби виразності мови, які допомагають висловом придбати яскравість і барвистість сприйняття.
Часто в якості епітетів в промові використовують назви хімічних речовин, властивості яких викликають певні асоціації. Наприклад, епітет «свинцеві хмари» позначає низькі, важкі хмари сіро-синього кольору, схожі на просту речовину свинець.
Згадайте подібні «хімічні» епітети і спробуйте пояснити їх значення, та наведіть приклади, які оформіть у додатку (Додаток 6).
9тур. Числові величини.
Всього 5 питань. Вибрати одну відповідь з трьох запропонованих. Кожна команда по 1 питанню.
Слайди № 33-38.
Питання 1.
Куховарській сіллю, витягнутої тільки з морської води, можна було б засипати всю сушу земної кулі шаром ....?
|
130 метрів |
1300 метрів |
13 метрів |
Питання 2.
Кажуть: «Щоб пізнати людину, треба з ним пуд солі з'їсти. Виявляється це не так вже й багато. Людина в рік з'їдає з їжею приблизно ...... ..? »
|
1,5кг |
800г |
8 кг |
Питання 3.
Атом кожного елемента складається з позитивно і негативно заряджених частинок. Маса атома зосереджена в ядрі. У скільки разів діаметр ядра менше діаметра атома?
|
У 10 – 100 тисяч разів |
У 100 разів |
У 100 тисяч - 1 млн. раз |
Питання 4.
Якщо зібрати всі молекули, що містяться в 1см.куб водню і розташувати всі ці молекули в одну лінію, скажімо нанизати на нитку, як намисто, то довжина цієї нитки була б близька до ... ..?
|
11 тис. км |
11 млн. км |
1,1 млн. км |
Питання 5.
Сніжинки утворюють шубу планети - сніговий покрив. Вага самої сніжинки близько міліграма, рідка - 2-3. Уявіть, кількість сніжинок, що утворюються на планеті за рік, вже підраховано. В одному кубічному метрі снігу знаходиться 350 мільйонів сніжинок, а по всій Землі - ... ..?
|
1042 |
1024 |
10240 |
Відповіді оформлюються учасниками кожної команди в додатку 7.
Відповіді:
|
1 |
130 метрів |
|
2 |
8 кг |
|
3 |
У 10 – 100 тисяч разів |
|
4 |
11 млн. км |
|
5 |
1024 |
10 тур. Метаграми. Відносяться до вербальним або словесним іграм.
Слайди № 73-76 Відповіді оформлюються в додатку 8 ( Додаток 8).
Метаграми 1.
Два елементи хімічних
Б’ють з метаграми, як дзвін:
З «Х» ― елемент металічний,
З «Б» ― не метал уже він.
Відповідь: Хром - Бром
Метаграми 2.
Коли «Т», він ― елемент,
Та врахуй такий момент:
Виправи лиш «Т» на «Р» ―
Деспот править відтепер.
Відповідь. Титан - Тиран.
Метаграми 3.
У назві відомого металу замініть одну букву і отримаєте назву спеціального органу, що виробляє речовини, які забезпечують життєдіяльність організму.
Відповідь. Залізо - Залоза.
Метаграми 4.
Коли з «Н» ― я радіоактивний
Елемент, який у світі знають.
Коли з «Л» ― я гори, що й донині
Азію й Європу розділяють.
Відповідь. Уран - Урал.
Додатковий конкурс «ФОТОКОНКУРС»
Слайди 77-82 (За правильну відповідь 2 бали). Кожна з команд отримує можливість по черзі відповісти на фото запитання – хто або що зображене на картинці.
1. Англійський хімік, фізик і філософ Поклав початок новому напрямові у хімії, в основі якого була вимога вивчення складу речовин експериментальним методом. Уперше запровадив наукове поняття про хімічний елемент, один із засновників якісного хімічного аналізу ( Роберт Бойль).
2. Шведський фізик – хімік, творець теорії електролітичної дисоціації. (Сванте Ареніус)
3. Вона відома людина з давніх-давен. Легендарний давньогрецький поет Гомер, який вважається автором поеми «Одіссея», зазначає, що вона застосовувалась для паління під час релігійних обрядів. У 941 році завдяки їй під стінами Царграду було знищено флот київського князя Ігоря. За фізичними властивостями це крихка кристалічна речовина жовтого кольору. Не проводить електричний струм. У воді не розчиняється і водою не змочується.. (Сірка)
4. Цей елемент був першим металом, який замінив каміння в первобутніх знаряддях праці., його сплав з оловом називається бронзою, використовується в виробництві електричних дротів. (Мідь)
5. Ці птахи дуже чутливі до вмісту в повітрі метану. Цю особливість використовували в свій час шахтарі, які, спускаючись під землю, брали з собою клітку з цією пташкою. Якщо співу давно не було чути, значить слід було підніматися наверх якнайшвидше (Канарки).
6. Існує ще один цікавий вид пароутворення, коли тверда речовина, мінуючи рідкий стан, перетворюється на газ. Така здатність притаманна йоду, нафталіну і звичайному «Сухому льоду» ( Сублімація).
Підведення підсумків гри. Виставляння оцінок та нагородження.
Ведучий 1. Дякуємо командам за цікаву гру, а глядачам – за увагу. Не все
добре.
Наш захід вже підходить до завершення,
то прийміть від нас ці щирі слова.
Спасибі Вам гості, за Вашу увагу
За Вашу сердечну, за дружню повагу
За оплески щирі, за теплі посмішки
Хотілось би з Вами побути ще трішки.
Ведучий 2: Прощатись нам настав вже час
Приходьте ще у гості до нас.
Прощатись нам настала пора.
Усім ми Вам бажаємо Добра.
ВИСНОВКИ
Анатолій Гін вважає « Ідеальна дидактика – це її відсутність. Учень сам прагне до знань так, що ніщо не може йому перешкодити. Нехай гасне світло – він буде читати при свічках» [10].
Я не згодна, що дидактика не потрібна. Учень сам повинен прагнути до знань і отримувати ці знання, але вчитель в сучасних умовах повинен знати засоби і прийоми (нові технології), щоб навчити дітей навчальної діяльності.
Щоб сформувати в учнях соціальні якості і моральну самосвідомість необхідно організовувати і постійно зберігати сферу їх «особистісних» відносин, створювати відповідні умови, стимулювати самодіяльність дітей. І допомагає цьому використання дидактичних ігор, тому що гра – це засіб створення «дитячого суспільства».
Гра або ігрова діяльність несе в собі дві самостійні самодостатні сторони «життя» учасників. Перша - це сама гра з її правилами, сюжетом, результатами. Друга - взаємини учасників в ході гри. Ось це друге життя і є то, що повинні засвоїти діти в ході морального виховання. Гра - це діяльність, в ході якої відбувається засвоєння найрізноманітніших знань і розвиток психіки дитини. Таким чином, дидактична гра на уроках повинна постійно поповнювати, поглиблювати і розширювати знання, бути засобом всебічного розвитку розумових, інтелектуальних і творчих здібностей дитини, викликати лише позитивні емоції, радість, наповнювати життя колективу учнів цікавим змістом, сприяти самоствердженню дитини.
В іграх присутня фантазія дітей, розвиваються творчі здібності; самостійний пошук відповіді, активність учнів; новий погляд учнів на вже відомі явищі і факти; поповнюються і розширюються знання; встановлюються зв’язки, свобода вибору в учнів; цілепокладання і навик досягнення мети. В іграх в різних поєднаннях і формах відбувається повторення вивченого матеріалу, і що дуже ціно, учні самі цього бажають. Коли дитина грає, в ній виробляються моральні норми, виховується впевненість в собі і самодостатність.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
1. Античні поетики . Поетика / Арістотель. Про високе / Псевдо-Лонгін. Про поетичне мистецтво / Горацій ; [упоряд. : Мирон Борецький, Василь Зварич ; голов. ред. М. Жук ; ред. Г. Бітківська ; худож. О. Здор ; редкол. : Мирон Борецький, Мирослав Закалюжний, Василь Зварич та ін.]. — Київ: Грамота, 2007. — 167, [1] с. : іл. — (Серія «Бібліотека античної літератури»).
2. Сухомлинський В.О. Серце віддаю дітям / В.О. Сухомлинський – 2-ге вид. – К.: Рад. Школа , 1971
3. Ковбань В. Ігрова діяльність учнів як засіб підвищення якості знань з хімії / В. Ковбань // Хімія. – 2009. - №12 – с.4-8
4. Прищепа С. Г. Використання гри для розвитку пізнавальної активності учнів на уроках хімії / С. Г. Прищепа // Хімія: БЖ. - 2006. - №11. - С.42-49
5. «Ребуси українською» © rebus1.com
6. Щипачев С. Избранные произведения в 2-х т. - Москва: Художественная литература, 1970.
7. Круглицький М. М. Дивовижний світ хімії. — К.: Рад. шк., 1984.
8. Гончаров А.І., Павлов В.Л. Хімія в житті та діяльності людини . – К.:В-во Київ. ун-ту, 2006.
9. Денисюк В. Хімічні загадки і ребуси / В. Денисюк. – Хімія. Шкільний світ, №14, 2006.
10. Гін А.О. Прийоми педагогічної техники: Свобода вибору. Діяльність
Зворот- ний зв’язок. Ідеальність: посібник для вчителя / А. О. Гін. — 13-е видан- ня. — Х. : Вид. група «Основа», 2015. — 112 с.



