Упровадження компетентнісного підходу шляхом міжпредметної інтеграції на уроках хімії
Останнє редагування: -1-11-30
ДЕПАРТАМЕНТ ОСВІТИ
ВІННИЦЬКОЇ МІСЬКОЇ РАДИ
КУ «ЦЕНТР ПРОФЕСІЙНОГО РОЗВИТКУ ПЕДАГОГІЧНИХ ПРАЦІВНИКІВ ВІННИЦЬКОЇ МІСЬКОЇ РАДИ»
ЗАКЛАД «ЗАГАЛЬНООСВІТНЯ ШКОЛА І-ІІІ СТУПЕНІВ №15
ВІННИЦЬКОЇ МІСЬКОЇ РАДИ»

Упровадження компетентнісного підходу шляхом міжпредметної інтеграції на уроках хімії
номінація «Навчально – методичний посібник»
Чульфа Лариса Володимирівна
вчитель хімії
«спеціаліст вищої категорії»
тел. (096) 98-37-557.
м. Вінниця
2021
Автор Чульфа Лариса Володимирівна, вчитель хімії закладу «Загальноосвітня школа І-ІІІ ступенів №15 Вінницької міської ради»
Чульфа Л.В. Впровадження компетентнісного підходу шляхом міжпредметної інтеграції на уроках хімії. Методичний посібник /Л.В.Чульфа – Вінниця: ММК, 2021. 92с.
Рецензенти:
Рекомендовано методичною радою
Закладу «Загальноосвітня школа І-ІІІ ступенів №15
Вінницької міської ради»
(Протокол № 4 від 25.02.2021 р.)
В методичному посібнику викладені розділи теоретичної та практичної частини. У теоретичній частині посібника розглянуті концептуальні положення, основні засади компетентісного підходу в освітньому процесі Нової української школи.
Розділ практичної частини включає висвітлення основних засад формування предметних компетентностей в курсі хімії .
Мета посібника – ознайомити учителів хімії з формуванням предметних компетентностей на уроках та позаурочний час, існуючими педагогічними технологіями, показати їх застосування на уроках для більш цікавого, різноманітного та ефективного навчання дітей, створення ефективних механізмів їх упровадження. Сприяти формуванню в учнів предметних та життєвих компетентностей.
Зміст
Вступ. 4
Розділ ІІ. Розвиток ключових компетентностей учнів на уроках хімії 12
2.1. Розвиток критичного та творчого мислення учнів як шлях до
формування ключових компетентностей. 14
2.2. Використання ІКТ – як знаряддя для формування інформаційної компетентності. 19
2.3. Розв’язування задач - основа математичної грамотності. 21
2.4. Проектна технологія – універсальний метод для виховання.
компетентісної людини. 39
2.5. Використання практичних та лабораторних робіт для сприяння.
розвитку мислення та предметних компетентностей. 48
2.6. Позакласна робота з хімії. 51
Висновок. 54
Використана література. 57
Додаток 1. 59
Додаток 2. 66
Додаток 3. 74
Додаток 4. 77
Вступ
В Україні відбуваються перетворення на демократичну, соціально орієнтовану країну, що обумовило глобальні зміни у філософії освіти, визначенні її мети, завдань, методів діяльності.
Мета загальної середньої освіти визначена у Проекті Закону України «Про освіту». «Метою повної загальної середньої освіти є різнобічний розвиток, виховання і соціалізація особистості, яка усвідомлює себе громадянином України, здатна до життя в суспільстві та цивілізованої взаємодії з природою, має прагнення до самовдосконалення і навчання впродовж життя, готова до свідомого життєвого вибору та самореалізації, трудової діяльності та громадянської активності» [1, с.3].
Необхідність реформування системи шкільної освіти України, що орієнтується на входження в європейський освітній простір та приєднання до “Болонського процесу”, потребує нових підходів, визначення пріоритетів освіти, які лежать в площині вирішення проблеми розвитку особистості дитини і спираються на прогресивні ідеї особистісно орієнтованого навчання: визнання самобутності, самоцінності учня, що вимагає забезпечення його розвитку як індивіда, який має неповторний суб’єктний досвід, формування особистості, високоосвіченої, суспільно активної, творчої, конкурентоспроможної, яка використовує знання як життєвий інструмент, генерує нові ідеї, приймає нестандартні рішення, вміє критично мислити, володіє комунікативними здібностями, впевнено відповідає на виклик нового тисячоліття.
Державний стандарт базової і повної загальної середньої освіти вимагає будувати навчально-виховний процес на засадах особистісно зорієнтованого, компетентнісного і діяльнісного підходів. Особистісно зорієнтований підхід до навчання забезпечує розвиток академічних, соціокультурних, соціально-психологічних та інших здібностей учнів, діяльнісний спрямований на розвиток умінь і навичок учня, застосування здобутих знань у практичних ситуаціях, а компетентнісний сприяє формуванню ключових, загально- предметних і предметних компетентностей.
Одним із шляхів оновлення змісту освіти й узгодження його із сучасними потребами є орієнтація на розвиток компетентностей та створення ефективних механізмів їх упровадження.
Україна стоїть на порозі переходу від індустріального до постіндустріального суспільства, а тому вимоги, потреби людини у ньому змінилися . Суспільство «Епохи інформації» (постіндустріальне) вимагає від людини:
1) певних умінь, які можна застосувати за будь-яких обставин;
2) уміння мислити, а не накопичувати певну суму знань і поглядів;
3) не вузьких знань, а загального підходу до вирішення питань;
4) комунікабельності — уміння працювати у злагоді з іншими і спільно доходити мети.
Необхідно переорієнтування навчання з засвоєння величезної суми знань, на освоєннякомпетентностей, необхідних для життя в XXI столітті. Вміння критично мислити, працювати в команді, фінансова грамотність, підприємництво, культурна компетентність.
Академік А.М. Несміянов висловив думку: “Ми переважно піклуємося про обсяг знань, а не про вміння їх використовувати. Будь-яка освіта – середня, вища – має розглядатися не як тренування мозку. Тренування мозку й у середній, і у вищій школі має бути посиленим. Якщо мозок тренований, то знання закріплюються легко, майже авоматично.”
Новий етап у розвитку шкільної освіти пов'язаний з упровадженням компетентнісного підходу до формування змісту та організації навчального процесу. Це вимагає певного підвищення професійної майстерності вчителя, доозброєння його новими знаннями, сучасними компетенціями, методами і технологіями, які б дозволили йому перебудувати навчально-виховний процес відповідно до нових вимог і підходів.
Компетентнісна освіта зорієнтована на практичні результати, досвід особистої діяльності, вироблення ставлень, що зумовлює принципові зміни в організації навчання, яке стає спрямованим на розвиток конкретних цінностей і життєво необхідних знань і умінь учнів.
Розділ І. Теоретичні засади компетентісного підходу в освітньому процесі.
«Освічені українці, всебічно розвинені, відповідальні громадяни і патріоти, здатні до ризику та інновацій, – ось хто поведе українську економіку вперед у ХХІ столітті». [1, с. 8]
Сучасний світ складний. Дитині недостатньо дати лише знання. Ще важливо навчити користуватися ними. Знання та вміння, взаємопов’язані з ціннісними орієнтирами учня, формують його життєві компетентності, потрібні для успішної самореалізації у житті, навчанні та праці. Ключові компетентності – ті, яких кожен потребує для особистої реалізації, розвитку, активної громадянської позиції, соціальної інклюзії та працевлаштування і які здатні забезпечити особисту реалізацію та життєвий успіх протягом усього життя.
Аналіз теоретичних джерел засвідчив, що проблема впровадження компетентнісного підходу в освіті знаходиться в центрі сучасної педагогічної думки відображена у нормативних документах про школу, активно розробляється вітчизняними та зарубіжними вченими. Існує багато поглядів науковців щодо основоположних питань компетентнісного підходу.
Компетентність – загальна здатність людини раціонально діяти урізноманітних ситуаціях, ефективно розв’язувати актуальні проблеми у різних сферах життєдіяльності. Компетентність є кінцевим результатом навчання, мета якого полягає у формуванні й розвитку особистості учня, розкритті його здібностей і талантів.
Компоненти структури компетентностей, основні його елементи це: знання, діяльність, мотивація, цінності. Усі вони взаємодоповнюють і знаходяться під впливом соціальної взаємодії.
У проекті нового базового Закону України “Про освіту”, Стаття 1: “Компетентність – динамічна комбінація знань, способів мислення, поглядів, цінностей, навичок, умінь, інших особистих якостей, що визначає здатність особи успішно провадити професійну та/або подальшу навчальну діяльність”. [2, c.5].
В Концепції Нової української школи наголошено на суб’єктності учіння, необхідності оволодіння учнями способами навчальної діяльності, досвіді взаємодії з іншими людьми.
Компетентність – загальна здатність людини раціонально діяти у різноманітних ситуаціях, ефективно розв’язувати актуальні проблеми у різних сферах життєдіяльності. Компетентність є кінцевим результатом навчання, мета якого полягає у формуванні й розвитку особистості учня, розкритті його здібностей і талантів. Компоненти структури компетентностей, основні його елементи це: знання, діяльність, мотивація, цінності. Усі вони взаємодоповнюють і знаходяться під впливом соціальної взаємодії.
Компетентності дозволяють усунути суперечливості між засвоєними теоретичними відомостями та їх використанням для розв’язання конкретних життєвих задач:
• уміти розрізняти об’єкти, ознаки, властивості;
• аналізувати і пояснювати причини і наслідки подій, вчинків, явищ;
• створювати тексти, вироби, проекти;
• висловлювати ставлення до подій, вчинків своїх та інших;
• брати участь в колективних справах; у розв’язанні навчальних завдань; оцінювати вчинки, різні моделі поведінки ;
• користуватись певними предметами .
Ключові компетентності пов’язують воєдино особистісне і соціальне в освіті, відображають комплексне оволодіння сукупністю способів діяльностей, що створює передумови для розроблення індикаторів їх вимірювання; вони виявляються не взагалі, а в конкретній справі чи ситуації; набуваються молодою людиною не лише під час вивчення предметів, але й засобами неформальної освіти, впливу середовища [ 4, с. 7].
У Концепції Нової української школи викладені ключові компетентності, визначені «Рекомендаціями Європейського парламенту та Ради Європи щодо формування ключових компетентностей освіти впродовж життя» (18.12.2006). До їх числа належать такі:
У Законі «Про освіту» визначено, зокрема, 10 груп компетентностей:
✓ Спілкування державною мовою.
✓ Спілкування іноземними мовами.
✓ Математична грамотність.
✓ Компетентності в природничих науках і технологіях.
✓ Інформаційно – цифрова компетентність.
✓ Уміння навчатись впродовж життя.
✓ Соціальні і громадянські компетентності.
✓ Ініціативність і підприємливість.
✓ Загальнокультурна грамотність.
✓ Екологічна грамотність і здорове життя. [ 3, c.3]
Предметна хімічна компетентність учнів є складником ключової компетентності у природничих науках і технологіях. Володіння хімічною компетентністю на базовому рівні означає здатність учнів мислити і діяти з позицій світоглядних орієнтацій і ціннісних установок, сформованих у процесі навчання хімії.
Предметну компетентність з хімії розглядаємо як загальну здатність
людини адекватно діяти у реальних ситуаціях, ефективно вирішувати актуальні проблеми, які передбачають оперування такими поняттями, як хімічний елемент, речовина, хімічне явище, хімічне виробництво.
Головними показниками сформованості в учнів предметних компетентностей з хімії та основні аспекти їх прояву наступні:
• пояснювально – аналітичний,
• прогностичний,
• проектувальний,
• дослідницько – експериментальний,
• ціннісно – орієнтаційний [8, c.12]
Сучасна педагогічна система хімічної освіти орієнтована на формування творчої особистості, вимагає вдосконалення методики викладання хімії, її модернізації з метою сприяння розкриттю природних інтелектуальних і творчих здібностей учнів. Необхідно не лише забезпечити учнів багажем знань, але й виховати інтелектуально розвинену особистість, що буде прагнути одержати ці знання. Інтерес учня до хімії залежить не стільки від змісту предмета, скільки від переконання у важливості власне процесу навчання, а ефективність цього процесу залежить не лише від здібностей учня. Необхідно навчити свого учня, щоб було в кого вчитися. Тут можна навести слова Едісона: “Найважливіша задача цивілізації – навчити людину мислити”.
У сучасній школі компетентності учнів орієнтовані на розвиток особистості та пов’язані з культурою мислення, самостійністю й відповідальністю за прийняття рішень в органічному поєднанні з моральними якостями особистості.
Компетентна людина має такі якості:
• упевненість у собі, постійне розширення власних можливостей, реалізація намічених цілей;
• здатність адекватно діяти в динамічному світі, непередбачуваних ситуаціях, професійна мобільність;
• здатність до навчання протягом усього життя;
• адекватність оцінки власних сил, здатність знаходити можливості для їх реалізації;
• здатність приймати рішення й досягати результату відповідно до поставленої мети;
• здатність брати на себе відповідальність за свої вчинки, бути терпимим до інших людей.
Знання є важливим елементом компетентності. Вони повинні бути: науковими, глибокими, міцними, систематичними, різнобічними.
Тому вивчення хімії в школі має велике значення не лише для наукового сприйняття світу, але й, у першу чергу, для розвитку творчих здібностей учнів, уміння мислити і використовувати свої знання на практиці.
З метою формування творчої особистості, сприяння розкриттю природних інтелектуальних і творчих здібностей учнів необхідно не лише забезпечити їх багажем знань, але й виховати інтелектуально розвинену особистість, що буде прагнути одержати ці знання.
Зміст роботи вчителя хімії з формування ключових компетентностей:
- «Спілкування державною та іноземними мовами – формувати
вміння усно і письмово висловлюватися рідною мовою, тлумачити поняття, факти, терміни. А іноземними мовами – розуміти і тлумачити поняття, формувати вміння міжкультурного спілкування.
- «Математична грамотність» - розвивати уміння застосовувати
математичні методи для вирішення розрахункових та прикладних задач.
- «Компетентності в природничих науках та технологіях» - дуже тісно пов’язана з вивченням хімії, розвивати умінням розуміти природні процеси, спостерігати, проводити експеримент, аналізувати його.
- «Інформаційно – цифрова компетентність» - вміння впевненно, а водночас критично використовувати ІКТ для пошуку, обробки, обміну інформацією, раціональне використання комп’ютерних засобів для розв’язування задач.
- «Вміння вчитися» - набуття учнями досвіту практичної та експериментальної діяльності, застосування знань у пізнанні світу.
- «Громадянська і соціальна компетентність» - усвідомлення цілісного образу своєї країни на основі розгляду та аналізу взаємовідносин людина – суспільство, формування в учнів ціннісних орієнтацій у стосунках з людьми, вміння поводитися та проявляти себе в суспільстві.
- «Підприємливість» - виховання активної життєвої позиції, готовності до конкурентної боротьби на ринку праці, ініціативно включатися в підприємницьку діяльність, уміння генерувати нові ідеї та втілювати їх в життя з метою підвищення власного статусу та добробуту.
- «Загальнокультурна грамотність» - ознайомлення учнів з науковими досягненнями з хімії, інших предметів, формування ціннісних орієнтацій, культури поведінки.
- «Екологічна грамотність і здорове життя» - уміння раціонально та розумно користуватися природними ресурсами, здатність і бажання дотримуватись здорового способу життя. [3, c.44]
У сучасній школі компетентності учнів орієнтовані на розвиток особистості та пов’язані з культурою мислення, самостійністю і відповідальністю за прийняття рішень в органічному поєднанні з моральними цінностями особистості.
Сучасні інтерактивні методи навчання сприяють реалізації компетентнісного підходу до навчання.Вчителю неодноразово слід здійснювати мотивацію навчання хімії в загальному смислі, що і є змістовим наповненням так званих предметних і ключових компетентностей учнів.
Саме тому в своїй роботі під час викладання хімії застосовую такі форми і методи, які б збуджували творчість учнів, створювали атмосферу розкутості, емоційного піднесення, залучали позашкільні інтереси і захоплення дітей до навчального процесу.
Особливістю сучасної науки є інтеграція – прагнення до об’єднання теоретичних знань у цілісну систему, формування в учнів систематизованих знань, умінь і навичок. Оновлення змісту освіти має полягати саме в інтеграції – об’єднанні знань, а відповідно умінь і навичок, у певну цілісність [13, c.54]. Інтеграція є інноваційним підходом до удосконалення процесу навчання. В школі запроваджуються інтегровані уроки, на яких поєднуються знання з близьких за змістом предметів, що сприяє цілісності здобутих знань. Принцип міжпредметних зв’язків передбачає, щоб знання і уміння, набуті під час вивчення суміжних предметів, ставали опорними при засвоєнні нового матеріалу, особливо при формуванні хімічних понять, а також при узагальненні знань[5, c. 4].
Розділ ІІ. Розвиток ключових компетентностей учнів на уроках хімії
Основна мета компетентісного підходу в освіті є оволодіння учнями різними вміннями, які дозволять їм у майбутньому діяти ефективно в різноманітних ситуаціях професійного, особистого і суспільного життя. По суті, особливого значення надається компетентностям, що дозволяють діяти в нових, невизначених проблемних ситуаціях, для яких неможливо заздалегідь спланувати алгоритм виконання дій. Компетентнісний підхід пов'язаний з підсиленням прикладного та практичного змісту шкільної освіти. Цей напрям став відповіддю на запитання про те, якими отриманими знаннями учень може скористатися поза школою.
Сучасний урок – це урок, на якому присутній демократичний стиль спілкування, де діти вчаться здобувати знання, а не отримувати готові, де навчають не тільки словом, а й організованою справою, де створені умови для розвитку ініціативності, самостійності та набуття ще в шкільному віці досвіду вирішення проблем, реалізації власних можливостей як в освітній, так і в практичній діяльності.
За словами доктора пед. наук Н. Маслова: « Завдання педагога в тому, щоб підвести до дверей, дати ключ і навчити учня користуватися цим інструментом. Ніхто, крім самого учня, не зможе ввійти у світ знання.»
У контексті освітніх реалій сьогодення ця мета може конкретизуватись як підготовка учнів до життя, розвиток їх інтелектуальних і творчих здібностей, опанування знань, актуалізація вмінь, необхідних у житті - уміння спілкуватись, контактувати з іншими людьми, у тому числі задля розв'язання конкретних проблем, уміння опрацьовувати інформацію, гнучко реагувати на зміни в житті . Отже, мета навчання виступає нині як формування життєвої компетентності учнів, шляхів формування компетентності учнів, можливостей продуктивного навчання з урахуванням умов та специфіки викладання навчального предмету.
Напрями роботи для досягнення мети:
- викладання хімії як дисципліни, що забезпечує гармонійну адаптацію особистості в навколишньому світі, її соціальне становлення;
- надання шкільному курсу хімії дослідницько-проектної спрямованості, що реалізується через розвиток експериментальних умінь та навичок;
- надання шкільному курсу хімії практичної спрямованості – формування знань, умінь і навичок як одного з етапів підготовки учня до самостійного життя.
Використовуючи різні нестандартні форми роботи, інноваційні методи навчання спонукаю учнів до активної розумової діяльності, сприяю зростанню інтелекту, розвитку творчих здібностей. А це, в свою чергу, допомагає формувати творчу особистість.
Навчальна діяльність у кінцевому результаті повинна не просто дати людині суму знань, умінь чи навичок, а сформувати рівень компетенцій.
На основі отриманих знань, сформованих умінь і якостей учень уміє взаємодіяти з навколишнім світом, не тільки адаптується до суспільства, але й активно бере участь у його процесах, впливає на самого себе і свої життєві обставини.Процес навчання і виховання спрямовую на розвиток ключових компетентностей шляхом використання інноваційних технологій. Така форма організації навчально – виховного процесу створює комфортні умови, за яких кожен учень відчуває свою успішність, інтелектуальну спроможність.
Інтерактивні методи розвивають критичне мислення, уміння міркувати, аналізувати, розв’язувати проблемні ситуації. У своїй роботі я поєдную різні інноваційні технології. Це сприяє формуванню компетентної особистості, підвищує мотивацію до навчання, зацікавленість до предмету.
Щоб зацікавити учнів, мотивувати їх на вивчення хімії, пов’язати навчання з вирішенням практичних завдань, формувати міжпредметну компетентність шляхом практичної реалізації на уроках: хімія – біологія, хімія – географія, хімія – фізика, хімія – математика, хімія – екологія, хімія – інформатика, хімія – історія.
2.1. Розвиток критичного та творчого мислення учнів як шлях до
формування ключових компетентностей.
Одним із методів, який допоможе досягти поставлених завдань, є формування критичного і творчого мислення як пріоритетних напрямків інтелектуального розвитку людини. Нині завдання навчити учнів думати критично стало особливо актуальним. Світ стає дедалі складнішим. Обсяг інформації, яку засвоюють діти, з кожним днем зростає. Завдання учнів – не тільки ефективно здобувати нові знання, а й критично і ретельно досліджувати нову інформацію, аналізувати і просіювати її, оцінювати нові ідеї, вирішувати, що важливо, а що ні, визначати загальну цінність нових знань на основі власних потреб і цілей.
Критичне мислення починається як перехід від навчання, орієнтованого переважно на запам'ятовування, до навчання, спрямованого на розвиток свідомого самостійного мислення учнів.
Людина, яка критично мислить, вмітиме;
• визначити проблему;
• перевірити використану інформацію;
• проаналізувати твердження, що є основою інформації;
• враховувати альтернативні точки зору;
• визначати наявність підтексту в інформації;
• робити висновки;
• приймати оптимальні рішення.
Ці навички потрібні всім: учневі на уроці, покупцеві в супермаркеті, громадянинові на виборчій дільниці, менеджерові на робочому місці.
Опрацювання у 9-х класах теми «Реакції обміну між розчинами електролітів, умови їх перебігу. Йонні рівняння» супроводжується елементами інтерактивного навчання, починаючи з найпростіших інтерактивних технологій, таких, як мозковий штурм, хімічна розминка, робота в парах і малих групах, мікрофон.
Використовувати їх можна як на етапі актуалізації та коригування знань учнів, так і під час узагальнення матеріалу. Ця технологія дозволяє кожному дуже швидко відповісти на поставлені питання або висловити свою думку чи позицію. Для цього я даю учням невелику вказівку, що виконує роль мікрофона. Я задаю запитання, а учні, передаючи один одному уявний “мікрофон”, відповідають на них. Учні повинні говорити швидко й лаконічно (спілкування державною мовою). Під час використання цієї технології відповіді не коментуються й не оцінюються. Іноді цей прийом поєдную з роботою “незакінчені речення”.
Для колективного обговорення використовую технологію “мозковий штурм”. Кожному надається можливість висловитися, всі ідеї приймаються й не критикуються. Така технологія спонукає учнів до вияву творчості, дає їм можливість вільно висловлювати власні думки (ініціативність, громадянські компетентності). Для засвоєння великого обсягу інформації за короткий проміжок часу ефективною є технологія “ажурна пилка”, що сприяє навчанню й дає учням можливість передати свої знання однокласникам (уміння навчатися впродовж життя, компетентності в природничих науках). Для цього підбираю матеріал, необхідний для уроку, поділяю клас на групи, кожен учасник одержує кольоровий трикутник або квадрат. У первинних групах учні одержують й обговорюють блок інформації, після чого розходяться по експертних групах за кольорами. В експертних групах кожен учасник ділиться блоком своєї інформації, після чого всі повертаються у свої групи та обмінюються отриманою інформацією. А для коригування знань первинним групам можна дати певне завдання відповідно до теми.
Внутрішня мотивація учнів до навчання виникає поступово. У багатьох вона нестійка і залежить від ситуації. На уроках на етапі мотивації навчальної діяльності застосовую різні методичні прийоми для підтримки пізнавального інтересу в дітей, потреби в нових знаннях: «Дивуй!», бо здивування — початкова фаза розвитку пізнавального інтересу; «Відстрочена відгадка» — на початку уроку загадую загадку (маловідомий або дивний факт), на яку відгадку можна дізнатися під час вивчення нового матеріалу; «Фантастична добавка» — реальна ситуація доповнюється елементами фантастики.
На етапі мотивації навчання використовую проблемні питання, які пробуємо розв’язати на протязі уроку (додаток 1,презентація 1).
При формуванні компетентності саморозвитку і самоосвіти використовую різні типи завдань:
— завдання, що встановлюють зв’язок між теоретичними знаннями і практичними діями;
— завдання на самоспостереження;
— завдання, що сприяють розвитку дослідницьких навичок.
З метою формування соціальної компетентності, що забезпечує уміння робити вибір, приймати рішення, брати відповідальність, безконфліктно співіснувати, пропоную учням завдання різного рівня складності, при цьому не розподіляю завдання, а учні самі обирають їх собі.
При проведенні контрольних робіт у ІV рівні складності даю учням декілька творчих завдань, а вони самостійно обирають собі одне. Вибір учнями певних завдань свідчить про їх здатність до самооцінювання.
Вміння самостійно приймати рішення, йти на компроміс, досягати спільної згоди формую в учнів при проведенні узагальнюючих уроків. Заздалегідь знайомлю з формами їх проведення (семінар, тестові завдання, контрольна робота, захист проектів), а школярі самостійно роблять вибір і повідомляють про це мені.
Для розвитку соціальної компетентності часто використовую групову форму навчання. Ефективна ця форма навчання при розгляді будови, властивостей та значення вуглеводів, будови білків, органічних сполук. Учні в групі обговорюють хід виконання проблемного завдання, розподіляють між собою обов’язки, обирають рецензента з іншої групи. Все це формує в них вміння приймати рішення, робити власний внесок у спільну справу, розвиває здатність до самооцінки і адекватної оцінки інших.
Ефективна групова форма роботи і при проведенні лабораторних та практичних робіт.
З метою формування загальнокультурної компетентності, що передбачає оволодіння досягненнями культури, розуміння інших людей, їхньої індивідуальності та відмінностей за національними, культурними та релігійними ознаками, на уроках часто використовую фрагменти з художніх творів. Вони позитивно впливають на образне мислення учнів, здатність висловлювати оригінальні ідеї. Літературні твори використовую на різних етапах уроку: під час вивчення нового матеріалу, його закріпленні, розв’язуванні творчих завдань. Значно ширше використовую художні твори у позакласній роботі.
У ході вивчення нового матеріалу розповідаю учням про діяльність вчених, що зробили вагомий внесок у розвиток хімії. З метою формування загальнокультурної компетентності звертаю увагу учнів на зв’язок хімії з іншими природничими та
суспільними дисциплінами і на значення хімії для розвитку цивілізації.
Для того, щоб підвищити пізнавальне і виховне значення хімії у школі, необхідно покращити її зв’язок із життям, що дасть можливість підвищити інтерес учнів до предмету. На перший погляд здається, що вже зараз, під час вивчення, здійснюється тісний зв’язок із життям, тому що програмою передбачається політехнічна підготовка учнів [3, с.58]. Зв’язок хімії із життям необхідно розуміти досить широко. Це не тільки знайомство з продуктами хімічного виробництва, але й знання найважливіших хімічних процесів, що відбуваються в живих організмах. Цей зв’язок можна і необхідно показати в рамках хімічних понять, здійснюючи міжпредметні зв’язки та проводячи інтегровані уроки. Завдання з міжпредметним змістом особливо важливі оскільки впливають на розумову діяльність учнів, розвивають їх інтереси під час вивчення природничих предметів [8, с. 19].
Розвиток компетентності продуктивної творчої діяльності здійснюю шляхом самостійного складання учнями задач, тестів, запитань до теми. Найкращі варіанти тестів використовую для перевірки знань інших учнів. Для розвитку уяви пропоную учням творчі завдання.
Учні основної школи на уроках демонструють свою творчість у складанні хімічних казок, вікторин, коміксів, кросвордів. Наприкінці вивчення теми вони мають право отримати високу оцінку за такі завдання. Щоб спонукати дітей думати, аналізувати інформацію, часто використовую такі вправи, як «Мозковий штурм», «Своя опора». Вправа «Заперечую» допомагає формувати вміння учнів розмірковувати, звільняє їх від механічного запам’ятовування, зазубрювання.
Для формування творчих здібностей практикую ігри – змагання, рольові ігри, дидактичні ігри («Вірю – не вірю», «Відгадай за описом», «Світлофор», «Розумники й розумниці», «Бумеранг», «Впіймай помилку», «Утвори пару», «Сніжна грудка», «Шпаргалка»).
В 9 класі під час вивчення органічних сполук пропоную учням дискусію з теми «Трансгенні продукти: за чи проти», «Спирт для людини: благо чи зло?» Вчу у ході дискусії учнів логічно мислити, толерантно відстоювати свою позицію, дослухатись до думки інших.
Творчу продуктивну діяльність учнів активізую за допомогою нестандартних уроків.
З метою формування комунікаційної складової компетентності, що передбачає розвиток в учнів культури мовлення, уміння ставити запитання, висловлювати власні думки і аргументовано їх доводити, здатність до толерантного спілкування, використовую роботу в групах, інтерактивні вправи «Я тобі – ти мені», «Завершіть фразу», «Я так думаю», «Мікрофон», «Мозковий штурм».
Розвиток монологічного мовлення здійснюю під час усного опитування, повідомлень учнів, захисту проектів, рефератів, коментування дослідів. Бесіди, диспути, семінари, конференції, уроки - змагання, уроки – мандрівки сприяють розвитку діалогічного мовлення учнів. Навички письмового викладу матеріалу формую під час написання учнями повідомлень, рефератів, науково – дослідницьких робіт, проектів.
2.2. Використання ІКТ – як знаряддя для формування інформаційної компетентності.
Інформаційно-комп’ютерні технології готують учнів до повноцінної діяльності в умовах сучасного інформаційного суспільства. Так під час вивчення хімії вони підвищують ефективність навчального процесу, розвиток уміння експериментально-дослідницької діяльності учня.
Я прагну самостійно створювати уроки, де провідна роль залишається за мною, а комп’ютер виконує роль асистента, засобу інтенсифікації, контролю та оцінювання навчальної діяльності учнів. Такі уроки мають різні прийоми й методи навчання, тут кожне заняття – окрема презентація, що складається з певної кількості слайдів, залежно від обсягу навчального матеріалу. Презентації на час дистанційного навчання можна вважати одним із найефективніших сучасних засобів у освітньому процесі.
Використання мультимедійних презентацій може забезпечити наочність, що сприяє комплексному сприйняттю й кращому запам’ятовуванню матеріалу. Запитання вчителя спонукають учнів висловлювати свої думки. Проведення уроків з елементами гри та використання комп’ютерних технологій на уроках допомагає розв’язанню такої важливої проблеми, як зацікавлення хімічними знаннями, активізує пізнавальну діяльність учнів, сприяє кращому розумінню та узагальненню вивченого матеріалу.
Цілком очевидно, що під час інтенсивного розвитку інформаційно-комунікаційних технологій відбуваються кардинальні зміни в навчальному процесі. Разом з тим, без змін лишається основна мета вчителя, яка полягає в тому, щоб забезпечити учня знаннями, уміннями та навичками, тобто, компетентностями, які необхідні йому у подальшому житті. Але сьогоднішній світ змінюється дуже швидко, і тому не треба сподіватись на те, що знань, отриманих учнем за шкільною лавою, вистачить на все життя. Сучасна людина приречена лишатися учнем усе своє життя, вона має навчатися упродовж усього життя, щоб не залишитися на його узбіччі. І саме від того, як відбуватиметься ця постійна адаптація учня до зовнішнього середовища, яке постійно змінюється, буде залежати його успіх та самореалізація. Саме тому завдання сучасного вчителя полягає в тому, щоб не лише надати певну суму знань відповідно до навчального плану та програми, але і надати йому життєво важливих навичок збирання необхідних даних і відомостей, умінь ефективно взаємодіяти з однокласниками, зберігати та презентувати результати своєї роботи. А ці навички можна прищепити в процесі навчання лише тоді, якщо вчителі самі почнуть використовувати їх у своєму повсякденному житті.
Отже, інноваційність як показник якості освіти забезпечує умови розвитку особистості, здійснення її права на індивідуальний творчий внесок, на особистісну ініціативу, на свободу саморозвитку .
Перед учителем хімії стоїть непросте завдання — формувати предметні компетентності учнів на кожному уроці, у кожній темі окремо, при вивченні курсу хімії в цілому. Реалізувати його зможе тільки професійний, творчий, інноваційно освічений учитель, здатний виховати сучасну компетентну особистість випускника.
Хімія – наука, створена людьми і заради людей. «Вивчення хімії має двояку мету: одна - удосконалення природничих наук, інша - примноження життєвих благ» М.В. Ломоносов
Надзвичайно важливо повсякчас показувати зв’язок хімії з життям суспільства, роль хімії у розвитку цивілізації, бо сьогодні необхідне не так поглиблення специфічних знань з хімії, як їх соціокультурна адаптація. Необхідно звузити розрив між хімією та реаліями повсякденного життя, зробити хімічні знання особистісно значимими для кожного учня, “вивести” знання за межі кабінету хімії і застосовувати їх для пояснення реальних явищ природи, суспільства, власного життя. Це дозволить в умовах нової школи виховувати компетентну особистість, яка не лише володіє знаннями, а й уміє адекватно діяти у складних ситуаціях, застосовуючи знання й беручи на себе відповідальність за свою діяльність, оскільки без цього людина не має шансів адаптуватися до динамічних умов середовища.
Одним із напрямків перебудови сучасної школи є пошук та обґрунтування шляхів інтеграції розрізнених навчальних дисциплін. У цьому випадку інтеграцію розуміють як об’єднання знань з окремих навчальних дисциплін у єдине ціле. Вона необхідна у зв’язку з тим, що з’явилася потреба посилити увагу до пізнання цілісності навколишнього світу [11, с. 58]. Принципом інтеграції є те, що знання про природу, отримані учнями у VIII-XI класах, повинні об’єднуватися в єдине ціле шляхом пояснення їх на основі фундаментальних закономірностей природи.
Методика використання інформаційних технологій передбачає вдосконалення системи управління навчанням на різних етапах уроку, посилення мотивації навчання, підвищення інформаційної культури учнів та рівня підготовки у галузі сучасних інформаційних технологій, а також демонстрацію можливостей комп'ютера - не лише як засобу для гри.Учні в невимушеній обстановці краще аналізують, систематизують та узагальнюють, поглиблюють вивчений матеріал при цьому формується інформаційно-цифрова компетентність, вміння спілкуватися і взаємодіяти з всім різноманіттям реального світу, дає цілісне уявлення про світ в його інформаційній єдності (додаток 2, презентація 2).
2.3. Розв’язування задач - основа математичної грамотності.
Розв'язування різних типів розрахункових задач з хімії мають дидактичну можливість показати значимість хімічних знань, їх практичне застосування у побуті, медицині. Задачі виступають у якості мотиваційних факторів вивчення хімії та стимулюють учнів вивчати цей предмет. Уміння учнями розв'язувати розрахункові задачі з хімії свідчать про більш високий чим початковий рівень знань учнів з предмету. Систематичне використання вчителем у навчальному процесі задач дає можливість учням реалізувати свої знання і вміння, показати реальний рівень начальних досягнень, отримати високу оцінку і, в результаті, стверджуватись, впевнюватись у собі, отримувати задоволення від навчання і ріст бажання навчатися далі.
Дуже важливо використовувати завдання, які пов’язують життя з наукою, тобто є ситуації, з якими ми стикаємося в повсякденному житті, і часто не задумуємось, чому це так, а не інакше. Такі ситуації знайомі учням і вони з цікавістю шукають на них відповіді.
Розробка уроку на тему. Ступінь електролітичної дисоціації. Сильні й слабкі електроліти.
Мета: формувати компетентності: ключові – вміння спостерігати, аналізувати, робити висновки; здійснювати самоконтроль і само оцінювання, інформаційні – вміння осмислювати й використовувати інформацію з різних джерел (мовлення вчителя, однокласників, зміст підручника), комунікативні – вміння вільно висловлюватися, оптимально використовувати власні знання й сприйняту на уроці інформацію для результативної комунікації; соціальні – вміння продуктивно співпрацювати з однокласниками, вчителем; предметні –формувати поняття про ступінь дисоціації, сильні й слабкі електроліти; з`ясувати, чому кислоти мають різний ступінь дисоціації у розчинах, удосконалювати вміння пояснювати суть процесу електролітичної дисоціації, навички складання рівнянь електролітичної дисоціації лугів, кислот, солей, встановлювати відмінність між електролітами й неелектролітами, сильними і слабкими електролітами, вдосконалювати техніку проведення хімічного експерименту; розвивати психічні процеси: мовлення, увагу, спостережливість, слухове зосередження на інформації, креативне та логічне мислення, вміння аналізувати та узагальнювати; розвивати вміння спостерігати і порівнювати, порівнювати результати дослідів і робити висновки, встановлювати причинно-наслідкові зв’язки; розвивати довільну увагу; коригувати самоконтроль під час складання рівнянь електролітичної дисоціації речовин; виховувати бережливе ставлення до оточуючого середовища, культуру поведінки учнів, виховувати самостійність і працьовитість, вміння працювати в групі. Екологічне виховання.
Тип уроку: урок засвоєння нових знань.
Форми організації навчально-виховного процесу: фронтальна, групова, індивідуальна.
Методи навчання: словесні, частково-пошукові, практичні , інтерактивні, використання ІКТ.
Обладнання: таблиця розчинності, періодична система хімічних елементів.
Базові поняття й терміни: електролітична дисоціація, ступінь дисоціації, сильні та слабкі електроліти.
Міжпредметні та внутрішньопредметні зв’язки: математика (цифрові та буквені вирази),українська мова –сенкан.
ХІД УРОКУ
I. Організація класу
II. Перевірка домашнього завдання.
Мотивація навчальної діяльності
Фронтальне опитування (хімічний диктант) або гра «Світлофор»
|
Варіант І |
Варіант ІІ |
|
1. Електроліти це — ... |
|
|
2. Електролітична дисоціація — це. |
|
|
3. Вид хімічного зв’язку в молекулах електролітів: ... неелектролітів: ... |
|
|
4. Речовини, у результаті дисоціації яких утворюється лише один вид катіонів — H+, називаються. |
|
|
5. Речовини, у результаті дисоціації яких утворюється лише один вид аніонів — OH , називається. |
|
|
6. Напишіть рівняння дисоціації: |
|
|
HCl |
HBr |
|
KOH |
NaOH |
|
CuSO4 |
NaNO3 |
|
Al2(SO4)3 |
Fe2(SO4)3 |
Робота в парах
1. У розчині містяться іони: Na+, SO42-, NO3-, OH-, Cu2-, Ba2+.
• Напишіть формули електролітів, які могли помістити в розчин для одержання цих іонів.
• Назвіть іони, які не можуть одночасно міститися в розчині. Чому?
2. Виберіть речовини, у розчинах яких лампочка загориться:
• Натрій хлорид
• Етиловий спирт
• Хлоридна кислота
• Дистильована вода
• Бензин
• Натрій гідроксид
• Кальцій карбонат
• Калій сульфат
Спочатку ми разом з вами пограємо у гру «світлофор», Потім спробуємо відповісти на питання що таке ступінь дисоціації, сильні та слабкі електроліти. Згодом будемо тренувати мізки-розв’яжемо задачки і наприкінці витягнемо з пам’яті щось цінне - згадаємо що таке сенкан.
Гра "Світлофор".
1.Які речовини проводять електричний струм в твердому стані?
2.Назвіть частинки, що зумовлюють електропровідність цих речовин.
3.Що таке електролітична дисоціація?
4.Які речовини називаються електролітами?
5.Які речовини називаються неелектролітами?
6.Який тип зв`язку найбільш характерний для електролітів?
7.Що таке йони?
8.Які речовини утворюють катіони одного виду-Гідроген-іони?
9.Дайте означення лугів з точки зору електролітичної дисоціації.
10.Хто з вчених є основоположник теорії електролітичної дисоціації?
Учитель вказує на результати отримані під час гри "Світлофор".
ІІІ. Вивчення нового матеріалу
А чи дисоціює дистильована вода?
Обговорення проблеми.
Вода — слабкий електроліт.
Маємо визначити:
Який параметр визначає слабкий електроліт чи сильний?
Чи є чітка грань між сильними і слабкими електролітами?
Часто речовини взаємодіють з водою, утворюючи йони, не цілком, і в розчині залишаються непродисоційовані молекули електроліту.
Електроліти за ступенем дисоціації поділяються на сильні, слабкі та електроліти середньої сили
Тому для кількісної характеристики електролітичної дисоціації вводиться величина-ступінь електролітичної дисоціації. Ступінь дисоціації дорівнює відношенню кількості молекул,що розпалися на йони, до загальної кількості його молекул перед дисоціацією.
Ступінь дисоціації позначається грецькою α(альфа)
N (дисоц.)
α = -------------- × 100%
N (загальн.)
де Nдис — число молекул, що продисоціювали;
Nзаг — загальне число молекул, поміщених у розчин; а залежить від природи розчиненої речовини й розчинника.
Ступінь дисоціації – безрозмірна величина. Його виражають в одиницях або відсотках. Розв’язок задач:
- Що означає вираз: ступінь дисоціації дорівнює 0,20;50%;13%; 0,0014.
- Обчисліть ступінь дисоціації, якщо відомо, що за температури 25о С у воді розчинилося молекул речовини:
10 із 100; 10 із 80;
20 із 400; 50 із 150
3.Запис на дошці та в зошитах
За температури 18о С ступінь дисоціації води дорівнює 1.4 10-9. Обчисліть, скільки молекул продисоціює в1 л води.
Розв’язання: ν (Н2О) = 1000/18=55,55 (моль).
N (дисоц.)
α = -------------- × 100%
N (загальн.)
N (загальн.)= ν Na, де Na=6,02 10 23
N (дисоц.)= N (загальн.) α =1.4 10-9 55,55 6,02 10 23=4,68 1016(молекул).
Чому дорівнює ступінь дисоціації при повній дисоціації електроліту?
При повній дисоціації електроліту на йони α =1 або 100%,а неелектроліту α =0.
Речовини, ступінь дисоціації яких високий (α =1), називаються сильними електролітами.
Речовини ступінь дисоціації яких низький, - це слабкі електроліти.
До сильних електролітів належать речовини, які складаються з йонів, тобто солі та луги. Процес дисоціації – необоротний, і в рівняннях дисоціації ставлять знак «дорівнює».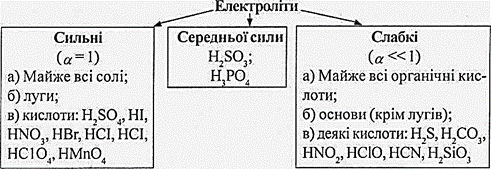
Сила електроліту залежить від:
Полярності хімічного зв’язку: якщо зв'язок сильнополярний, то легше він розривається з утворенням йонів.
Сила електроліту залежить також від природу електроліту і природи розчинника, концентрації розчину, температури та інших чинників.
Ступінь електролітичної дисоціації речовини α залежить від природи розчиненої речовини й розчинника.
Наведемо приклади. Розглянемо процес розчинення за допомогою досліду, спочатку купрум (II) хлориду. Наллємо в склянку 30 мл води і всипимо 5 г цієї солі. Розчин набуває синьо-зеленуватого кольору. Якщо далі будемо потрохи підливати води, то колір розчину переходить у блакитний.
|
1-колір розчину купрум (II) хлориду в невеликій кількості води. 2- колір розчину купрум (II) хлориду зі збільшенням об’єму води |
Якщо занурити електроди приладу на визначення електропровідності в розчинах (а) та (б), то електропровідність розчину (б) буде краща, лампочка світиться яскравіше.
Чому розчин з зеленуватого переходить у блакитний?
Збільшується число дисоційованих кристалів, які далі дисоціюють на йони: катіони Купруму Cu2+ та аніони Хлору Cl.
Як же себе поведе концентрований розчин сульфатної та оцтової кислоти?
Якщо занурити електроди приладу для визначення електричної провідності в концентрований розчин оцтової кислоти, то нитка розжарювання в лампочці ледь жевріє, а в концентрованій сульфатній кислоті світиться дуже яскраво.При розчинені концентрованих розчинів сульфатної і оцтової кислоти та перевірки на електропровідність цих розчинів приладом, в розбавлених розчинах сульфатної та оцтової кислот лампочка світитиметься яскраво.
Чому так відбувається?
У концентрованій речовині молекули оцтової кислоти майже не дисоціюють. При розчиненні розчину оцтової кислоти число дисоційованих молекул збільшується. Якщо ж занурити електроди приладу на визначення електропровідності в концентрований і розбавлений розчин харчової солі –натрій хлориду, то розчинення майже не впливає на яскравість світіння лампочки.
На базі розглянутих дослідів можна зробити висновок: речовини йонної будови (солі, луги), що добре розчиняються у воді, практично всі є сильними електролітами.
Якщо α = 1, то при розчинні у воді електроліти повністю розпадаються на йони. Прийнято вважати, якщо :
α > 0,3, або 30% то це сильні електроліти (солі, луги, сильні мінеральні кислоти: H2SO4, HNO3, HCl, HI, HF, HClO4, HMnO4);
від 3% < α < 30% - електроліти середньої сили (H3PO4, H2SO3, HF);
α < 3% - слабкі електроліти ( H2O, NH4OН - нашатирний спирт, органічні кислоти, H2CO3, H2SiO3, H2S, HNO2, HClO, HCN).
Отже, електроліти мають ступінь дисоціації: ← 3% - α - 3% →
У розчинах слабких електролітів одночасно міститься молекули і йони розчиненої речовини.
Нагадаємо, що процес дисоціації електролітів оборотній, а у середніх і слабких електронів він буде ще й ступінчатий. Кожний наступний етап дисоціації буде проходити важче і важче, тому що дія сили притягування в йоні зростає.
I-ша ступінь : H3PO4 ↔ H + + H2PO4
II-га ступінь : H2PO4 ↔ H ++ HPO42
III-тя ступінь: HPO42 ↔ H ++PO43
Сумарне рівняння: H3PO4 ↔ 3H+ + PO43
Поділ розчинів електролітів на сильні та слабкі електроліти умовний, ступінь дисоціації α змінюється за умов:
- підвищення температури;
- зменшення концентрації розчинених речовин;
- зміни розчинника.
Серед кислот є як сильні,так і слабкі електроліти.
Кислоти - це електроліти, які дисоціюють в розчині на йони Гідрогену та кислотні залишки. Чим міцніший зв'язок атомів Гідрогену з кислотним залишком, тим важче розірвати його і тим слабшою є кислота.
Проблемне питання: чому в ряді HF-HCl-HBr-HI сила кислот збільшується?
Зверніть увагу на радіус атомів галогенів. В молекулі HF зв'язок між атомами найслабший і ця кислота є найсильнішою.
Отже, хімічна активність кислот залежить від кількості йонів Гідрогену у розчині.
Силу оксигеновмісних мінеральних кислот можна визначити за таким правилом:
сила кислоти тим більша, чим більша різниця між кількістю атомів Оксигену й Гідрогену в її молекулі.
Якщо формулу кислоти записати у вигляді Е(ОН)пОm,то m-визначає силу кислоти: якщо m-менше або дорівнює 2 –кислота слабка, якщо m-більше або дорівнює 2-сильна.
Умовно прийнято вважати: якщо:
• α > 30 % — електроліт сильний (солі, луги, сильні кислоти);
• 2 % < α < 30 % — електроліт середній (H3PО4, НF);
• α < 2 — слабкі електроліти (H2О, NH4ОH, органічні кислоти, H2CО3, H2SiО3, H2S та ін.).
Дисоціація середніх і слабких електролітів оборотна й поетапна. Ступінь дисоціації відіграє важливу роль у процесах, що протікають у розчині. У розчинах слабких електролітів одночасно містяться і іони, і молекули розчиненої речовини. Наприклад, у розчині карбонатної кислоти:
![]()
Одночасно в розчині можуть міститися три види іонів, молекули карбон(ІІ) оксиду й карбонатної кислоти.
Узагальнюємо, що поділ на сильні та слабкі електроліти умовний. Ступінь дисоціації α змінюється за умов:
• підвищення температури;
• зменшення концентрації розчинених речовин;
• заміни розчинника.
Наприклад, у 98%-му розчині H2SО4 (слабкий електроліт), у разі розведення ступінь дисоціації збільшується.
Набуті знання використовуємо при розв’язанні завдань.
IV. Творче застосування отриманих знань (керована практика)
Завдання 1
Запишіть рівняння поетапної дисоціації речовин:
• H2CО3;
• Mg(ОH)2;
• H3PО4;
• Ca(ОH)2.
Завдання 2
А). Що означає вираз: ступінь дисоціації дорівнює 0,25; 50 %; 15 %; 0,0017?
Б). Обчисліть ступінь дисоціації, якщо відомо, що за температури 25 °С у воді розчинилося молекул речовини:
• 20 із 200;
• 10 із 80;
• 30 зі 100;
• 50 зі 150.
Завдання 3
Засоби для чищення кухонних плит, мікрохвильових печей, посуду, універсальний засіб чищення для кухні, каналізаційних труб, адсорбуючі медичні препарати. Застосовуючи ці засоби, потрібно користуватися гумовими рукавичками.Чому?Тому що складовими перелічених засобів є основи. Луги застосовуються:
NaOH: виробництва мила, паперу, штучних волокон;
KOH: рідкого мила, акумуляторів;
LiOH: в лужних акумуляторах;
Ca(OH)2: пом’якшення води, дублення шкіри, в’яжучий матеріал в будівництві;
Mg(OH)2: виробництва лікарських препаратів;
Al(OH)3: компонент зубних паст, компонент твердого реактивного палива, вироблення лакових фарб, адсорбуючий засіб у медицині.
А зараз я вам хочу продемонструвати дослід, яким можна скористатись для видалення плям від зеленки на тканинах.
Дослід. У склянку з водою додаємо зеленку. Потім пероксид водню, потім засіб для чищення «Крот», який продається в магазинах і використовується як засіб очищення. Тому що в своєму складі він містить луг натрію гідроксид. При додаванні цього засобу колір зникає. Таким способом можна очистити пляму на тканині. Тільки замість «Крота», використати слабший луг - амонію гідроксид (нашатирний спирт, який, ви знаєте, продається в аптеці).
Задача №1
Обчислити, скільки молекул продисоціювало із 120 взятих молекул. Якщо ступінь дисоціації електроліту натрій гідроксиду становить 95%.
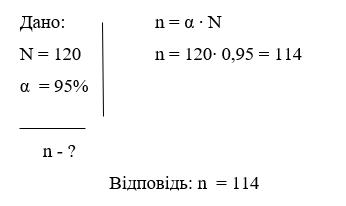
Задача № 2.
Обчисліть та позначте кількість речовини катіонів у розчині, що містить розчинений калій нітрат, що використовується в сільському господарстві як мінеральне добриво /калійна селітра/, використання для виробництва чорного пороху) кількістю речовини 5,5 моль.
Задача №3
Обчисліть та позначте масу аніонів у розчині, що містить розчинений натрій сульфат (використовується для виробництва скла, соди) кількістю речовини 32 моль.
Задача №4
Обчисліть та позначте число катіонів у розчині, що містить розчинений ферум (ІІІ) сульфат кількістю речовини 10,5 моль, якщо вважати, що сіль повністю продисоціювала.
Закріплення
Лови помилку!(так,ні)
1. Для розчинів кислот, основ, солей характерна діркова електрична провідність.(ні)
2. Дисоціація електроліту може відбуватися повністю і частково.(так)
3. Ступінь дисоціації показує електронегативність електроліту.(ні)
4. Сильні електроліти не дисоціюють.(ні)
5. Сильні електроліти дисоціюють практично повністю.(так)
6. Ступінь дисоціації показує, яка частка електроліту розпалася на йони.(так)
7. Слабкі електроліти утворюють мало йонів.(так)
8. Дисоціація слабких електролітів оборотна, відбувається у протилежних напрямах за тих самих умов. (так)
Контроль
Опитування ланцюжком
- Ступінь дисоціації –це відношення…
- Ступінь дисоціації виражають у…
- Електроліти поділяють на…
- Сила електроліту залежить від…
- Сильні електроліти дисоціюють практично… дисоціація необоротна, відбувається в одному…
- Дисоціація слабких електролітів оборотна, відбувається у …
Повідомлення домашнього завдання
Особливе завдання
Підготувати алгоритми (щонайменше 2) розв’язку задач ( приклад розв’язаної задачі обов’язково) з теми «Ступінь дисоціації»
Рефлексія. Підведення підсумків уроку.
Хімічний сенкан
1.Що?(1 буква)( α)
2. Що є?(3 іменника, 1 прикметник )(йони, молекули розчиненої речовини)
3. Що робить?(3 дієслова)(змінюється, обчислюється, вимірюється)
4. Що показує?(коротке речення 7 слів)(яка частка електроліту розпалася на йони)
5. Формула. ( N (дисоц.) )
α = -------------- × 100%
N (загальн.)
Оцінення роботи учнів на уроці.
У вас на парті лежать смайлики, прошу відповісти на питання піднімаючи відповідний смайлик (так-сміється,посередньо-серйозний,ні-незадоволений):
- Чи всі основні моменти теми вам були зрозумілі?
- Чи зрозумілий розвязок задач з даної теми?
- Чи зрозумілі теоретичні питання розглянуті на уроці?
- З яким настроєм завершуємо урок.
Окрім того, задачі з хімії реалізують міжпредметні зв'язки, оскільки тісно пов'язані із використанням знань з алгебри (виготовлення розчинів з певною масовою часткою шляхом змішування розчинів з відмінним масовими частками, застосування системи рівнянь з двома невідомими при розв'язуванні задач на встановлення мас чи масових частин компонентів сумішей тощо), фізики (обчислення кількості частинок у певній кількості речовини, використання розрахунків, пов'язаних з об'ємом, масою та густиною розчинів) та багато інших прикладів. Тобто, в даному випадку вже йде мова про формування не лише предметних, а й ключових компетентностей учнів. Найкращим виявом міжпредметних зв’язків є проведення інтегрованих уроків, які спрямовані на розширення знань з певної теми, формування здатності сприймати предмет різнобічно, системно .
Фрагмент уроку
Як визначити, не куштуючи на смак, який розчин більш солоний: виготовлений із 15 г солі та 285 г води або із 9 г солі та 141 г води?
Розв’язання задачі із застосуванням формули масової частки речовини під керівництвом учителя хімії:
Розрахуємо маси розчинів: m1 = 15 + 285 =300 г,
m2 = 9 + 141 =150 г.
Розрахуємо масові частки солі у розчинах:
ω1 = 15*100%/300 = 5%
ω2 = 9*100%/150 = 6%
Масова частка солі у другому розчині більша, тому він солоніший.
Розв’язання задачі математичним способом під керівництвом учителя математики:
Спробуємо розв’язати цю задачу за допомогою пропорції, скориставшись результатами m1 = 300 г, m2 = 150 г.
 .
.
Учитель хімії: Давайте змінимо питання задачі. Скільки потрібно додати води у солоніший розчин, щоб зрівняти їх концентрації?
(Рішення задачі учнями біля дошки)
5% * (150 + х) = 9* 100%
5х = 150
х = 30 (г)
Аби зрівняти концентрації солі в розчинах, потрібно до 6% розчину додати 30 г води.
Учитель математики: Як вирішити цю задачу за допомогою пропорції?
(Рішення задачі учнями біля дошки)
Так як кількість солі в розчині не змінюється, то
9 г - 5%
х г - 100%
х = 9*100/5,
х = 180
Тому маса нового 5% розчину 180 г і щоб зрівняти концентрації солі в розчині, у більш солоний розчин треба долити 180 – 9 – 141 = 30 (г) води.
Учитель хімії: А що буде, якщо змішати обидва розчини? Яку концентрацію буде мати новий розчин?
Розрахуйте масу солі у новому розчині.
Учень:
m3 = 15 + 9 = 24 (г)
Учитель хімії: Визначте масу нового розчину.
Учень: m (розчину)3 = 300 + 150 = 450 (г)
Учитель хімії: Розрахуйте масову частку цукру в новому розчині.
Учень: ω = 24*100%/450 = 5,3 (%)
Учитель математики: Чому дорівнює маса змішаних розчинів?
Учень: 300 + 150 = 450 (г), маса цукру у них: 15 + 9 = 24 (г).
Учитель математики: Складіть і розв’яжіть пропорцію:
Учень: 450 г – 100%
24 г – х%
х = 24 * 100/ 450
х = 5,3
Отже, вміст цукру в отриманому при змішуванні розчині 5,3%.
Учитель хімії: Задачі на змішування мають широку практичну спрямованість. Для домашньої консервації використовується столовий 9% оцет. А технологи галузей харчової промисловості використовують 80% оцтову есенцію. Розрахуйте, скільки потрібно взяти оцтової есенції та води, щоб отримати 1000 г столового оцту?
Рішення: За формулою знайдемо масу розчиненої речовини у першому розчині: m1в= 9%*1000/100%=90г
Знайдемо масу другого розчину (есенції): 90*100%/80%=112,5г
Знайдемо масу води, необхідної для виготовлення столового оцту:1000-112,5 = 887,5г
Відповідь: 112,5г есенції, 887,5г води.
Учитель математики: Як скоротити час на рішення задач подібного типу? Для цього використаємо правило хреста («конверт Пірсона»). Це так звана діагональна схема змішування. При розрахунках записують масові частки розчинених речовин одну над другою, а в середині – масову частку, яку потрібно отримати. По діагоналі з більшого значення віднімають менше значення. Різниці при відніманні показують масові частки для першого і другого розчинів, що необхідні для приготування потрібного розчину.
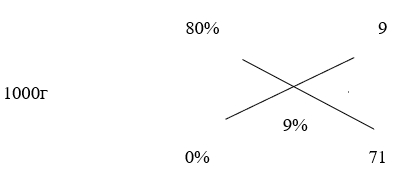
1000/ (71 + 9) * 71 = 887,5 г – води потрібно долити до есенції.
1000/ (71 + 9) * 9 = 112,5 г есенції.
Учитель хімії: Особливістю сьогоднішніх задач є їхня практична спрямованість та можливість рішення різними способами. Виберіть задачу і вирішіть її більш зручним для вас способом.
Задачі різних типів можна ефективно використовувати на всіх етапах уроку: на етапі мотивації навчання, для розвитку інтересу, творчих здібностей, під час постановки проблеми, що потребує розв'язання, у процесі формування нових знань, вироблення практичних умінь учнів, з метою повторення, закріплення, систематизації та узагальнення засвоєного матеріалу, для контролю якості засвоєння навчального матеріалу чи діагностування навчальних досягнень учнів тощо. Зміст умови задачі має бути наближений до реальних умов життя людини, спонукати до використання хімічних знань у певних життєвих ситуаціях.
2.4. Проектна технологія – універсальний метод для виховання
компетентісної людини.
Метод проектів при вивченні уроків хімії сприяє формуванню основних груп ключових компетентностей учнів. Уміння створювати, реалізовуватичи брати участь у проектах формує життєву компетенцію особистості.
Проектна технологія є одним із кращих прикладів формування та розвитку життєвих компетентностей учнів. Саме цей метод стимулює природну допитливість та творчий потенціал. В основі проектної технології лежить розвиток пізнавальної та дослідницької діяльності учнів, уміння орієнтуватися в інформаційному просторі.
Метод проектів — освітня технологія, спрямована на здобуття учнями знань у тісному зв'язку з реальною життєвою практикою, формування в них специфічних умінь і навичок завдяки системній організації проблемно-орієнтованого навчального пошуку.
Дослідницькі проекти потребують чітко продуманої структури, визначеної мети, актуальності проекту для всіх учасників, соціальної значимості, продуманих методів роботи.
Творчі проекти зазвичай не мають чітко продуманої структури, вона розвивається, підпорядковуючись інтересам учасників проекту. Оформлені результати можуть бути у вигляді збірника, сценарію, програми свята .
Ігрові проекти. Структура таких проектів залишається відкритою до їхнього закінчення. Учасники беруть на себе певні ролі. Результати можуть визначатися на початку проекту або до його завершення. Наявний високий ступінь творчості.
Інформаційні проекти спрямовані на збір інформації, її аналіз та узагальнення фактів. Потребують чіткої структури, можливостей систематичної корекції під час проектної діяльності
Практико-орієнтовані проекти відзначаються чітко визначеним із самого початку результатом діяльності учасників проекту, який зорієнтований на соціальні інтереси самих учасників, роботи потребують продуманої структури, навіть сценарію діяльності учасників із визначенням функції кожного. Дуже важливо добре організувати координаційну роботу через обговорення, корекцію спільних дій, презентацію отриманих результатів та можливих способів використання їх на практиці, зовнішню оцінку проекту.
Екологічне виховання та формування ключових компетентностей екологічної думки в учнів – важливе завдання сучасної школи. Щоб успішно охороняти наші ліси та водойми, землю та повітря від забруднення, а тваринний і рослинний світ від зникнення, треба знати
природу, глибоко розуміти її закони та цінність. Мало тільки милуватися красивим сходом сонця чи чарівною квіткою, треба ще вміти бачити серцем, відчувати, тобто отримувати від спілкування з природою заряд високих почуттів, благородства, духовної щедрості. А такому спілкуванню, звичайно, допомагає знання природи.
В умовах сучасної екологічної ситуації важлива екологізація всієї системи освіти та виховання підростаючого покоління. Актуальним є створення цілісної системи екологічної освіти, забезпечення її безперервності, в результаті чого кожна людина будь-якого віку
матиме можливість одержувати необхідні їй екологічні знання.
Виховання бережного, уважного ставлення до навколишнього середовища, формування навичок, спрямованих на покращення і охорону довкілля, повинні стати невід’ємною частиною загальної системи навчання та виховання.
Розвиток екологічної культури дітей шкільного віку здійснюється з метою формування основних екологічних понять у процесі вивчення навчальних дисциплін і в позакласній роботі, а також відповідального ставлення підростаючого покоління до навколишнього середовища та
здоров’я людини .
В даний час екологізація виховної роботи школи стала одним з головних напрямів розвитку системи шкільної освіти. Хімія є однією з основних природничих наук, з якою пов’язаний процес формування єдиних цілісних знань. Вона виступає як сполучна ланка неживого з живим. Тому одним із завдань позакласної роботи з хімії є формування специфічних навичок поведінки з речовинами, умінь грамотно застосовувати знання з хімії в спілкуванні з природою, показати гуманістичну спрямованість хімії, її зростаючу роль у
розв’язанні глобальних проблем людства, в тому числі й захисті довкілля від забруднення промисловими і побутовими відходами, виховувати екологічну культуру учнів .
Хімія як природнича наука є частиною духовної і матеріальної культури людства, а хімічна освіта – невідокремним складником загальної культури особистості, яка живе, навчається, працює, творить в умовах використання високих технологій, змушена протистояти екологічним ризикам, зазнає різнобічних упливів інформації. Хімічні знання створюють підґрунтя реалістичного ставлення до навколишнього світу, в якому значне місце посідає взаємодія людини і речовини, сприяють розкриттю таємниць живого через пізнання процесів життєдіяльності організмів на молекулярному рівні.
Теорія без практики ніщо. Учень, спробувавши себе в ролі дослідника, експериментатора максимально засвоює навчальний матеріал. Залучений в дослідницьку діяльність дитина перебуває на шляху просування від незнання до знання, від невміння до уміння, тобто усвідомлює сенс і результат своїх зусиль.
Тому я поставила за мету при вивченні хімії використовувати метод проектів, що сприяє формуванню компетентностей учнів. Проекти розробляються учнями індивідуально або в групах, я надаю консультацію щодо планування, визначення мети, завдань і методики дослідження, пошуку інформації, координую хід виконання проекту. Проектна робота може бути теоретичною або експериментальною. Тривалість проекту — різна: від уроку (міні-проект), кількох днів (короткотерміновий проект) до року (довготерміновий). Результати досліджень учні представляють у формі мультимедійної презентації, доповіді, тематичного масового заходу. Презентація й обговорення (захист) проектів відбувається на спеціально відведеному уроці або під час уроку з певної теми. Робота кожного виконавця проекту оцінюється за його внеском, індивідуально (презентації 3, 4 ).
Метод проектів завжди зорієнтований на самостійну діяльність учнів — індивідуальну, парну, групову, яку вони виконують протягом визначеного часу. Діти вчаться на власному досвіді й досвіді своїх товаришів, бачать результати своєї власної діяльності.Проектна діяльність школярів дозволяє розширити й поглибити знання учнів з хімії, активізувати їх пізнавальну діяльність, логічне мислення, навчальний матеріал засвоюється краще. Так, учні 9 класу провели дослідження впливу кислотності й лужності ґрунтів на розвиток рослин у шкільній галереї кімнатних рослин працюючи в групах і використовуючи знання з біології.
Як виміряти кислотність грунту - ph землі
Вивчити поняття "кислотність грунту". Провести лабораторне дослідження за рекомендованою інструкцією. Визначити рівень кислотності запропонованих зразків грунтів. Створити буклет "Рослини - індикатори".
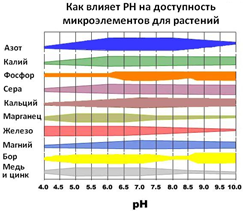
“Якість життя” рослин, і мікроорганізмів, необхідних для їх життєдіяльності, в значній мірі залежить від ph землі. Дерева, чагарники, плодово-ягідні культури отримують поживні речовини з води, розчиненої в землі, яку характеризує рн кислотність. Мікроелементи по-різному засвоюються рослинами в залежності від кислотності грунту. Якщо вимір ph грунту не виконано і грунт закислений, доставка корисних речовин ускладнена.
Приклад 1. Як видно з діаграми, доступність фосфору знижується при ph грунту
 Втрати від зниження врожайності, якщо не виміряти кислотність грунту, будуть відчутні для всіх:
Втрати від зниження врожайності, якщо не виміряти кислотність грунту, будуть відчутні для всіх:
Якщо знати як виміряти ph грунту, кислотність перебуватиме під постійним контролем і в деяких межах ph землі може регулюватися шляхом внесення мінеральних і органічних добавок і агрономічними заходами.
Що таке пш – шкала кислотності
Щоб розуміти як виміряти ph землі, необхідно оцінити вміст іонів водню в ґрунтовому розчині (розрахувати ph - Potentialofgydrogen).

Вимірювання ph грунту починається з приготування лабораторного розчину шляхом розчинення зразка грунту в воді для подальшого хімічного аналізу, щоб визначити кислотність ph.
- рн кислотність оцінюється як концентрація іонів H+ в 1 літрі води.
- Кислотність ph (грунту, землі) надзвичайно мала і безпосереднє визначення рн ґрунту призвело б до аналізу показників з багатьма нулями перед комою.
- Щоб виміряти кислотність грунту (розрахувати ph) і в подальшому використовувати ph землі в агрономії, рн кислотність приводиться до логарифмічної шкали з десятковою підставою, по-іншому іменується - шкала кислотності.
Приклад 2. Що таке пш - як розрахувати PH для дистильованої води
 Співвідношення кількості позитивних (H+) і негативних (OH-) іонів у чистій воді знаходиться в динамічному стані рівноваги. Молекули розпадаються на іони (процес дисоціації) і з'єднуються знову. Концентрація OH-і H + однакова і дорівнює 10-7 моль/литр, а результат перемноження складе 10-14.
Співвідношення кількості позитивних (H+) і негативних (OH-) іонів у чистій воді знаходиться в динамічному стані рівноваги. Молекули розпадаються на іони (процес дисоціації) і з'єднуються знову. Концентрація OH-і H + однакова і дорівнює 10-7 моль/литр, а результат перемноження складе 10-14.
Ось що таке пш - шкала кислотності дозволяє розрахувати ph в повному діапазоні вимірювання (рн кислотність) – від 0 до 14.Як виміряти ph грунту – лакмус індикатор, індикатор кислотності грунту. Поєднання “водневий показник” (кислотність ph) з'явилося в словниковому запасі ще на початку 20-го століття, коли ще не було винайдено вимірювач кислотності грунту ph-тестер і питання як виміряти кислотність грунту викликало об'єктивні труднощі.
На допомогу і тоді і зараз приходить хімія і з'явився індикатор кислотності грунту (лакмус індикатор) і можна ph смужки купити і хоч візуально, але виміряти кислотність грунту.
Ряд речовин, знайомих ще зі шкільного курсу (фенолфталеїн, лакмус) змінюють забарвлення в залежності від рівня кислотності ph тестованого розчину.
Для зручності вимірювання кислотності грунту можна ph смужки купити - індикатор кислотності грунту або лакмус індикатор з наступним зіставленням кольору - використовується шкала кислотності.
Але ph грунту вимірювання подібним чином - своєрідна візуальна шкала кислотності, має ряд обмежень і лакмус індикатор може бути рекомендований швидше як виняток:
- індикатор кислотності грунту вимагає приготування розчину, по іншому ph грунту вимір не вийде провести;
- · вимір ph грунту, використовуючи лакмус індикатор, не достатньо точний і однозначний - необхідно, щоб індикатор кислотності грунту не була простроченим і від властивостей колірного зору людини багато що залежить - суб'єктивний фактор;
- як виміряти кислотність грунту, якщо під рукою тільки індикатор кислотності грунту (лакмус індикатор), але визначення рн ґрунту потрібно провести в польових умовах, де немає насамперед лабораторної тари ? В цьому плані ph грунту вимір не така вже й проста справа.
Правда є і плюс. Якщо не знаєте як виміряти ph землі, але під рукою не присутній індикатор кислотності грунту, і ніде ph смужки купити, лакмус індикатор можна виготовити самостійно - знань шкільного курсу хімії вистачить, а рецептів в інтернеті маса, включаючи відеоролики.
Як виміряти ph землі - рослини індикатори кислотності грунту
 Улюбленим місцем існування для ряду рослин може служити грунт з нейтральною, лужною або кислотною основою. Це так звані рослини індикатори кислотності грунту, оригінальний природний лакмус індикатор.
Улюбленим місцем існування для ряду рослин може служити грунт з нейтральною, лужною або кислотною основою. Це так звані рослини індикатори кислотності грунту, оригінальний природний лакмус індикатор.
 - ph грунту з цієї хвилини під нашим повним контролем, а значить будете все чудово з кімнатними рослинами.
- ph грунту з цієї хвилини під нашим повним контролем, а значить будете все чудово з кімнатними рослинами.
Міжпредметні зв’язки хімії з біологією
Якщо подивитися на обмін речовин в організмі з хімічної точки зору, ми побачимо сукупність великої кількості порівняно простих і одноманітних хімічних реакцій, які сполучаються між собою в часі, протікають не випадково, а в суворій послідовності, у результаті чого утворюються довгі ланцюги реакцій. І цей порядок спрямований на постійне самозбереження і самовідтворення всієї живої системи в цілому в даних умовах навколишнього середовища. Такі специфічні властивості живого, як ріст, розмноження, рухливість, збудливість, здатність реагувати на зміни зовнішнього середовища пов'язані з певними комплексами хімічних перетворень. Саме хімією виявлено важливу роль хлорофілу як хімічної основи фотосинтезу, гемоглобіну як основи процесу дихання, установлено хімічну природу передачі нервового збудження, визначено структуру нуклеїнових кислот.
Вивчаючи хімічний склад речовин в клітинах рослин, тварин та людини згадуємо: а) формули неорганічних речовин – води та мінеральних солей;
б) формули органічних речовин – білків, ліпідів, вуглеводів, нуклеїнових кислот.
в) коли вивчаємо лікувальні властивості рослин згадуємо, які хімічні речовини вони накопичують, завдяки яким вони і мають лікувальну силу. Наприклад, коли вчимо пасльонові, то наголошуємо на тому, що серед них є отруйні рослини: блекота, дурман. Але в основному пасльонові – важливі сільськогосподарські та лікарські рослини.
Міжпредметні зв’язки хімії з екологією
Розуміння всіх хімічних процесів, що відбуваються в навколишньому середовищі, неможливе без урахування дії біотичних, абіотичних та антропогенних факторів. Нині люди впливають на стан біосфери, змінюючи її фізичний і хімічний склад, умови збалансованої віками біогенної міграції атомів. У майбутньому це може спричинити дуже негативні зміни, які набувають здатності саморозвиватися й стають глобальними, некерованими (опустелювання, деградація грунтів, вимирання тисяч видів організмів). За допомогою вивчення певних хімічних процесів, що лежать в основі головних екологічних проблем можна свідомо й активно запобігати розвитку таких негативних явищ, керувати біогеохімічними процесами. Хімія допомагає розробити науково обґрунтовані методи природокористування та охорони довкілля.
Мною спільно з вчителем екології, біології, географії О.О. Уманець разом з учнями була здійснена робота над науково-дослідницьким проектом «Подаруй річці нове життя». Практика показує, що методи і прийоми, які використовуються під час вивчення навчального матеріалу з хімії, екології з використанням методу проектів сприяють розширенню дидактичних можливостей; більш наочному поданню навчального матеріалу; ефективному засвоєнню теоретичних основ хімії і практичному їх застосуванню, підвищенню інтересу до предмету через активізацію пізнавальної діяльності учнів; самореалізації учнів; розвитку прийомів мислення: аналізу, синтезу, порівняння, узагальнення; розвитку практичних вмінь здійснювати обробку інформації; у стислій формі відтворювати інформацію; формуванню інформаційної культури; естетичному вихованню за рахунок використання комп'ютерної графіки, технології мультимедія; надбанню досвіду використання інформаційних технологій в індивідуальній та колективній навчально-пізнавальній діяльності.
Учасники працювали над довготривалим проектом «Подаруй річці нове життя» (про вплив хімічних речовин на стан довкілля та здоров`я). Відрадно, що на пропозиції учасників проекту схвально прореагувала “місцева влада”. Результати своєї діяльності учні презентували на ІІІ етапі екологічної олімпіади. Мета проекту полягала у екологічній характеристиці, комплексній оцінці сучасного стану струмка Дьогтянчик, річки Вишенька та Вишенського озера для обґрунтування заходів щодо покращення екологічного стану водойм та здоров’я людей (презентація 4,5).
Проектна технологія передбачає створення вчителем таких умов під час навчального процесу, за яких його результатом є вдосконалення індивідуальності учня, його потенціальних здібностей, виховання мотивації, особистісних та вольових якостей: самостійності, цілеспрямованості, організованості в роботі.
Проектна діяльність школярів дозволяє розширити й поглибити знання учнів з хімії, активізувати їх пізнавальну діяльність, логічне мислення, навчальний матеріал засвоюється краще. Так, учні 9 класу з великим захопленням проводять дослідження складу, властивостей, ролі та застосування органічних речовин, готові створювати проекти по всім класам сполук, працюючи в групах і використовуючи знання з біології, фізики, географії, технологій, пробують себе в ролі журналіста, соціолога, проводять анкетування серед школярів (презентації 3, 6, 7).
2.5. Використання практичних та лабораторних робіт для сприяння
розвитку мислення та предметних компетентностей.
Використання практичних та лабораторних робіт, що сприяють розвитку мислення та предметних компетентностей. Основною метою навчання учнів хімії є розвиток у них компетентностей, необхідних для творчої реалізації особистості, та набуття навичок самостійної науково-практичної та дослідницько-пошукової діяльності. Серед них чільне місце займають дослідницькі компетентності – складне особистісне утворення, яке може бути схарактеризоване через знання та уміння, необхідні для виконання дослідницької діяльності, позитивне ставлення до неї та усвідомлення її значущості незалежно від того, виконується вона особисто або спільно. Формування дослідницьких компетентностей відбувається та проявляється у оволодінні знаннями, уміннями і способами діяльності для ефективного здійснення навчально-дослідницької діяльності та здатності самостійно здобувати нові знання [2].
Розвиток дослідницьких компетентностей учнів відбувається зі збільшенням ступеня їх самостійності у здійсненні навчально-дослідницької діяльності.
Розвитку мислення та предметних компетентностей дітей, набуттю ними навичок самостійної роботи значною мірою сприяють практичні та лабораторні роботи. Не секрет, що окремі учні можуть непогано засвоювати навчальний матеріал, але не вміють застосовувати набуті знання під час виконання практичних завдань, не вміють порівнювати, аналізувати, відповідати на питання проблемного характеру. Правильно організовані практичні роботи сприяють розумінню сутності понять, розкриттю причинно –наслідкових зв’язків, що загалом забезпечує міцне та глибоке засвоєння знань. Практичні роботи можуть використовуватися на різних етапах уроку та з різною метою. Загалом ця форма роботи може бути визначена як діяльність, спрямована на використання, поглиблення та розвиток теоретичних знань у комплексі з формуванням необхідних для цього вмінь і навичок (самостійне використання підручника, статистичних матеріалів, наочних посібників). За її допомогою учні готуються до самостійного творчого пошуку. Практична робота може розглядатися і як шлях удосконалення та розширення знань, умінь, навичок, якими школярі вже володіють. Окрім того, використовуються ці роботи як засіб перевірки рівня знань та оволодіння основними програмними вміннями та навичками.
Часто, особливо в старших класах практикую проведення уроків –досліджень, коли учням треба дослідити властивості класу сполук, або конкретної речовини. Наприклад у 9 класі при вивченні будови та властивостей глюкози проводимо дослідження для виявлення складу та властивостей даної речовини. Під час вивчення білків цікаво проводимо лабораторні дослідження на виявлення білку та кольорові реакції білків. При виконанні даної роботи в учнів формується здоров’язбережувальна компетентність, коли вони спостерігають денатурацію білку під впливом спирту, нагрівання. При виконанні лабораторних і практичних робіт організовую групову роботу. Під час якої кожна група демонструє результати своїх досліджень.
Практична робота № 5 «Виявлення органічних сполук у харчових продуктах» ще раз підтвердила думку, що хімія в нашому житті займає набагато більше місце і має набагато більше значення, ніж ми думаємо. Чи то ми готуємо їжу, миємо посуд, ми весь час стикаємося з хімічними реакціями, хоча ніколи про це не задумуємося. Наш організм, кожна його клітина – це складна врегульована хімічна лабораторія зі своїми закономірностями і вимогами до умов навколишнього середовища. І чим більше знань з хімії отримає учень, тим менше він буде мати життєвих проблем.
Хімія без експерименту не дає цілісних уявлень про речовини та їх властивості. Тому поряд із традиційними хімічними експериментами на уроках я пропоную проводити домашні хімічні експерименти з використанням лікарських препаратів, харчових продуктів, тобто звичайних речовин і матеріалів, що дозволяє сформувати в учнів навички грамотного поводження з речовинами у повсякденному житті та сприяє формуванню життєвих компетенцій.
Домашній хімічний експеримент - це досліди, які учні самостійно виконують в домашніх умовах за завданням вчителя. Виходячи з означення цього поняття, можна зробити висновок, що домашній експеримент – це один із видів самостійної роботи учнів.
Домашній хімічний експеримент допомагає учням більш свідомо засвоїти основи наукових знань з хімії, активізує їх пізнавальну діяльність, сприяє формуванню вмінь самостійно здобувати знання, розвитку предметних компетенцій.
Домашній експеримент дає можливість формувати навички екологічно грамотної поведінки в побуті, навколишньому середовищі, розвиває здатність реально оцінювати ситуацію, виконує освітню, виховну та розвивальну функцію, а також сприяє формуванню ужиткових компетенцій у світі хімічних речовин, які нас оточують в житті, розуміння користі та шкоди продуктів хімічного виробництва, доцільності застосування хімічних продуктів, можливості змінити життя на краще, завдяки хімічним знанням, формувати навички безпечного користування хімічними реактивами, що використовуються у повсякденному житті, вплив шкідливих речовин на здоров’я людини і довкілля.
Для учнів – гуртківців було запропоновано провести експерименти в початковій школі в рамках вивчення теми в Новій українській школі «Ми дослідники, ми винахідники». Основна особливість компетентнісного підходу порівняно з традиційним, полягає в зміщенні акценту з нагромадження нормативно визначених знань, умінь і навичок до формування й розвитку в учнів здатності практично діяти, застосовувати індивідуальні техніки і досвід успішних дій у ситуаціях професійної діяльності та соціальної практики. Дев’ятикласники виступили в ролі вчителя у проведенні досліджень першокласникам, в поясненні явищ та перетворень, що сприяло підвищенню мотивації до вивчення хімії, удосконаленню навичок і умінь учнів у хімічному експерименті, практичному використанню отриманих знань під час вивчення інших предметів (математика, фізика,біологія, географія) (додаток 3).
2.6. Позакласна робота з хімії.
Розвивати здібності дітей, виявляти обдарованих учнів, стимулювати їх творче самовдосконалення, творчу активність, дати їм ґрунтовні, міцні знання озброїти їх практичним розумінням основ наук, підвищити їх інтерес до хімії, допомогти у виборі професії - це завдання, які дає можливість реалізувати позакласна робота з хімії. Основна мета позакласної роботи з хімії: допомога учням в формуванні стійкого інтересу до предмета, розширення світогляду та знань, естетичного та трудового виховання, формування життєвих та здоровязбережувальних компетенцій.
В позакласної роботі з хімії велика увага належить міжпредметним зв’язкам, це дуже важливо для профорієнтації учнів і розуміння хімії у житті людини. Для забезпечення масовості необхідно залучати більше учнів до підготовки та участі в заході. Видовищність вимагає наявність яскравих, цікавих і пізнавальних дослідів. Диференційований підхід потребує участь в заходах учнів різних здібностей. Інтерактивність передбачає творчі можливості не тільки учнів, але й учителя. Позакласна робота з хімії в нашій школі включає в себе проведення тематичних тижнів, виховних заходів екологічного спрямування, участь учнів в предметних олімпіадах. турнірах, участь в всеукраїнських інтерактивних конкурсах «Геліантус», «Колосок», конкурсах еколого – натуралістичного змісту.
В рамках проведення тижня природничих наук стараюсь долучати до участі якомога більше дітей. Для початкових класів організовую конкурси малюнків та плакатів на тему «Хімія в моєму житті» з подальшим нагородженням переможців. Агітбригада учнів старших класів проводять цікаві бесіди, вікторини для учнів початкової школи : «Вітаміни. Ці знайомі незнайомці», «Смачні кислоти».З метою зацікавлення предметом, разом з старшими учнями, проводимо цікаву екскурсію хімічним кабінетом, де розповідаємо про обладнання, правила техніки безпеки при роботі з ним. Учні 9 класу підготували для початківців хімічний ілюзіон, демонстрували цікаві досліди з хімії.
Для учнів , які вивчають хімію організовую проведення вікторин, КВК, круглих столів, хімічних перегонів, конкурси хімічних газет, уроки-суди (прикладом став захист проекту на тему «Дослідження достовірності реклами з погляду хімії: «Суд над тютюном»). Під час проведення таких заходів практикую проведення експериментів з підручних матеріалів, таких, які є в аптечці, дома. Такі експерименти викликають захоплення у дітей і зацікавленість предметом, учні багато цікавого дізнаються про таку таємничу науку хімію.
Позакласна робота допомагає розвивати в учнів вміння працювати з додаткової літературою, розвиває навички експериментальної роботи, вчить виступати перед аудиторією, працювати в команді, орієнтуватися в великій кількості інформації, аналізувати, порівнювати, виступати в ролі тренера, наставника, відчувати свою значущість .

Логічним продовженням реалізації міжпредметних зв’язків, як основи формування ключових компетентностей на уроках є позакласна робота, яка розширює, поглиблює і вдосконалює знання учнів, сприяє їх закріпленню. Проведення позакласних заходів дає змогу вселити в душу кожного учня розуміння нерозривності і всеохопленості навчання, показати, що у школі всі предмети покликані допомогти йому стати освіченою, багатогранною особистістю. Розвиткові творчої особистості учня, можливості проявити свою індивідуальність допомагають предметні тижні (“Хімія та біологія”, “Хімія та екологія”), участь у гуртку “Юний хімік”. Поєднання різних форм і методів на уроках хімії переконливо свідчать про доцільність учительського пошуку. Адже методика інтегрованого навчання хімії розширює можливості вчителя більш ефективно викладати матеріал, по-справжньому зацікавити ним учнів (додаток 4, презентація 11).
З метою ознайомлення вчителів природничого циклу міста з досвідом роботи щодо використання проектних технологій на уроках хімії, географії, біології та природознавства була проведена мною разом з вчителями Уманець О.О., Білоконною Н.В. педагогічна майстерня за темою: «Педагогічна майстерність проектна технологія навчання як засіб формування компентностей учнів на уроках природничого циклу та в позаурочний час».
На сьогодні освітня технологія функціонує і як наука, що досліджує найраціональніші способи навчання, і як система принципів та способів навчання, і як реальний процес навчання.
Досягаючи основної мети власного педагогічного пошуку, а саме формування життєвих компетенцій через практичну діяльність, використовуючи традиційні та новітні технології (інтеграцію, міжпредметні зв’язки, інтерактивні методи), приходи до думки, що все це дозволяє:
- підвищити мотивацію учнів до вивчення хімії;
- підвищити якість знань;
- активізувати пізнавальну діяльність учнів на уроках;
- полегшити розуміння учнями явищ і процесів, що вивчаються;
- аналізувати, зіставляти факти з різних галузей знань;
- здійснювати цілісне наукове сприйняття навколишнього світу;
- формуванню предметних загальноосвітніх компетентностей учнів .
Висновок
Компетентнісний підхід до формування понять розглядається як спрямованість процесу навчання на забезпечення здатності учнів використовувати засвоєні поняття в практичній діяльності під час розв’язання ситуацій і проблем реального життя. Для набуття учнями навчальних компетентностей під час вивчення окремих предметів необхідно вдосконалювати існуючу методику їх викладання. Це має здійснюватися з урахуванням таких психолого – педагогічних та методичних вимог:
- враховувати вікові та індивідуальні особливості учнів;
- під час вибору засобів навчання доцільно активно застосовувати засоби наочності та проблемні задачі.
Основними рівнями сформованості компетентності є: елементарна
хімічна грамотність, функціональна грамотність, компетентність. Важливим нині є не лише обсяг знань, а й уміння ними оперувати, бути готовим змінюватися та пристосовуватися до нових потреб ринку праці, оперувати й управляти інформацією, активно діяти, швидко приймати рішення, навчатися упродовж життя.
Розвиток навчання на сучасному етапі вимагає від учителя творчого підходу до проведення уроку, модернізації навчального процесу, використання інноваційних освітніх технологій:
- проблемного навчання,
- інформаційно-комунікаційних технологій,
- інтерактивних технологій,
- проектних технологій,
- дослідницьких технологій.
При використанні інтерактивних форм навчання вчитель з носія готових знань перетворюється на організатора пізнавальної діяльності своїх учнів. Він виконує функцію незалежного консультанта. Тому використовую різноманітні види самостійної діяльності пошукового, дослідного, творчого характеру.
Сприяю розвитку й підтримці інтересу дитини до предмета, розвиваючи її творчі прагнення, креативність, створюю продуктивне, творче середовище, атмосферу пошуку нового.
Навчаючись у школі, учень засвоює не монопредметні знання, а у його свідомості формується система знань, умінь, навичок з різних навчальних дисциплін. У процесі взаємозв’язаного навчання відбувається виховання, розвиток, формування особистості школяра.
Не менш важливим є і те, що міжпредметні зв’язки дозволяють більш доцільно планувати вивчення матеріалу, економити час, при цьому знання з інших предметів конкретизуються, поглиблюються, узагальнюються.
Таким чином, при систематичному використанні міжпредметних зв’язків, формуючи міжпредметну компетентність у учнів:
- Формується інтерес до хімії.
- Учні привчаються шукати зв'язок хімії з життям, що спонукає їх користуватися додатковими джерелами інформації.
- Підвищується якість знань учнів і рівень їх навченості.
- Вдосконалюються навички самоосвіти.
Потужну державу і конкурентну економіку забезпечить згуртована спільнота творчих людей, відповідальних громадян, активних і підприємливих. Саме таких повинна готувати середня школа України.
З метою формування творчої особистості, сприяння розкриттю природних інтелектуальних і творчих здібностей учнів необхідно не лише забезпечити їх багажем знань, але й виховати інтелектуально розвинену особистість, що буде прагнути одержати ці знання.
Кожна дитина – неповторна, наділена від природи унікальними здібностями, талантами та можливостями. Місія нової української школи – допомогти розкрити та розвинути здібності, таланти і можливості кожної дитини на основі партнерства між учителем, учнем і батьками. «Якщо вчитель став другом дитини, якщо ця дружба осяяна благородним захопленням, поривом до чогось світлого, розумного, у серці дитини ніколи не з’явиться зло», – писав Василь Сухомлинський.
Нова школа працює на засадах “педагогіки партнерства”, формуванні предметних компетентностей. Підсумовуючи вищесказане, можна зробити висновок, що урок — це центр, навколо якого обертаються і до якого повертаються всі думки і дії вчителя. При підготовці до уроку вчитель має пам'ятати, що на кожному уроці потрібні інтерес і захопленість самого вчителя, готовність самому дивувати і дивуватися. «Щоб запалити, треба горіти», Запалює сумлінна і всебічна підготовленість до уроку, емоційна щедрість учителя, його захопленість.
Компетентнісний підхід в освіті – це відповідь на вимоги часу. Динамічні зміни життя, оновлення інформації та колосальні темпи її нагромадження зумовлюють потребу в таких членах суспільства, які здатні гнучко і активно адаптуватися до нових вимог. Вчитель має бути не «транслятором» інформації, а організатором діяльності , спрямованої на виконання навчальних завдань. Тобто як би активно вчитель не намагався викладати свій предмет, якщо при цьому він не забезпечив активну діяльність учнів, процес навчання фактично не буде функціонувати. Що різноманітнішою є навчальна діяльність, то більшою розвивальною функцією наповнюється учіння. Дидактичні можливості конкретних тем курсу хімії дають змогу проводити цілеспрямовану ефективну роботу з формування всіх основних груп компетентностей.
Метою посібника є дослідження інтеграції знань, як одного з дидактичних принципів сучасної освіти. Обґрунтовано необхідність впровадження у освітній процес інтегрованих форм навчання, з метою формування предметноцілісного мислення у майбутніх фахівців.
Використана література
1. Закон України „Про освіту” (вiд 28 вересня 2017 року).
2. Закон України „Про загальну середню освіту” із змінами (від 28 вересня 2017 року).
3.Нова українська школа: порадник для вчителя / Під заг. ред. Бібік Н. М. — К.: ТОВ «Видавничий дім «Плеяди», 2017. — 206 с.
4. Державний стандарт базової і повної загальної середньої освіти (постанова Кабінету Міністрів України від 23 листопада 2011 р. № 1392).
5. Програма для загальноосвітніх навчальних закладів: хімія 7-9 класи, затверджена наказом Міністерства освіти і науки України від 07.06.2017 № 804
6. Пометун .О., Пироженко Л. Сучасний урок: Інтерактивні технології навчання. К. Видавництво А.С.К., 2008
7. Загнибіда Н. М. З-14 Метод проектів на уроках хімії. — Тернопіль–Харків: Ранок, 2011. — 128 с. — (Серія «Нові педагогічні технології»).
8. Буджак Т. Метод проектів як педагогічна технологія // Біологія і хімія в школі.- 2004. - №1,- С. 43-45.
9. Косогорова О. Метод проектів.— Х. : Ранок, 2008.— С. 9-42.
10. Гутак І. О. «Розвиток критичного мислення на уроках хімії через
діяльнісний підхід» Шосткинський НВК Сумської області.
11. Енциклопедія технологій та інновацій. /Автор укладач Н. П. Наволокова. - , Х.: Вид. група «Основа», 2012. – 176с. - (Серія «Золота педагогічна скарбниця»)
12. Розвиток критичного мислення (дещо з методики та досвіду). Укладач: Пальцева І.В.– Сокаль; відділ освіти Сокальської районної державної адміністрації, Великомостівський освітній округ, 2010. – 22с.
13. Родигіна І. В. Компетентісно орієнтований підхід до навчання. Х. «Основа», 2008
14. Садкіна В. І. 101 цікава педагогічна ідея. Як зробити урок. – Х.: Вид. група «Основа», 2011. – 88 с. - («Золота педагогічна скарбниця»)
15. Семенків О. М. Застосування технології розвитку критичного мислен-ня на уроках хімії та біології.Опис досвіду. КЗ «Любимівська ЗОШ І –ІІІст.
16. Пустовіт Г. П. Дослідницька діяльність дітей та учнівської молоді / Г. П. Пустовіт // Енциклопедія освіти / Головний редактор В. Г. Кремень ; Акад. пед. наук України. – К. : Юрінком Інтер, 2008. – С. 234-236.
17. БуринськаН. М. Методика розв'язування задач / Н. М. Буринська. - К.: Либідь, 1996. .
18. Решноеа С. Ф. Деякі питання методики розв'язування розрахункових задач з хімії. Навчально- методичні рекомендації / С. Ф. Решнова, І. П. Банківський. - Херсон: Видавництво, 2008. - 48 с.
19. Староста В. І. Навчання школярів складати й розв'язувати завдання з хімії: теорія і практика: моногр. / В. І. Староста. - Ужгород: Гражда, 2006. - 327 с.
20. Ярошенко О. Г. Збірник задач і вправ з хімії: навчальний посібник / О. Г. Ярошенко. - К.: Видавничий дім “Освіта”, 2015. - 272 с.
21. О. Іванець, Н. Тямушева. Реалізація інноваційних підходів при викладанні предметів природничо-математичного циклу. Методичний посібник,Вінниця-2019.
22. Інформаційні джерела інтернетресурсів.
Додаток 1
Тема уроку: Реакції обміну між розчинами електролітів, умови їх перебігу. Йонні рівняння.
Мета: формувати компетентності: ключові – вміння спостерігати, аналізувати, робити висновки; здійснювати самоконтроль і само оцінювання, інформаційні – вміння осмислювати й використовувати інформацію з різних джерел (мовлення вчителя, однокласників, зміст підручника), комунікативні – вміння вільно висловлюватися, оптимально використовувати власні знання й сприйняту на уроці інформацію для результативної комунікації; соціальні – вміння продуктивно співпрацювати з однокласниками, вчителем; предметні –формувати поняття про сутність реакцій йонного обміну, удосконалювати вміння пояснювати суть процесу електролітичної дисоціації, навички складання рівнянь електролітичної дисоціації лугів, кислот, солей, встановлювати відмінність між електролітами й неелектролітами, сильними і слабкими електролітами, формувати вміння записувати реакції в молекулярній, повній та скороченій йонній формах, вдосконалювати техніку проведення хімічного експерименту Розвивати психічні процеси: мовлення, увагу, спостережливість, слухове зосередження на інформації, креативне та логічне мислення, вміння аналізувати та узагальнювати; розвивати вміння спостерігати і порівнювати, досліджувати умови протікання реакцій йонного обміну до кінця, порівнювати результати дослідів і робити висновки, встановлювати причинно-наслідкові зв’язки; розвивати довільну увагу; коригувати самоконтроль під час складання рівнянь електролітичної дисоціації речовин, рівнянь реакцій обміну; виховувати бережливе ставлення до оточуючого середовища, культуру поведінки учнів. Виховувати самостійність і працьовитість, вміння працювати в групі. Екологічне виховання.
Тип уроку: урок засвоєння нових знань.
Форми організації навчально-виховного процесу: фронтальна, групова, індивідуальна.
Методи навчання: словесні, частково-пошукові, практичні (лабораторний дослід), інтерактивні, використання ІКТ.
Наочність та обладнання: таблиця розчинності кислот, основ, солей у воді, реактиви відповідно до змісту лабораторних дослідів, дидактичні картки «Третій зайвий», «Слідство ведуть хіміки», « Від теорії до практики», кросворд «Йонні рівняння», мультимедійна презентація №1.
Девіз уроку:
Великий шлях починається з маленького
кроку вперед
Хід уроку
І. Організаційний етап. Привітання, налаштування на робочий настрій, перевірка організації робочого місця, правила роботи на уроці.
II. Перевірка домашнього завдання. Актуалізація опорних знань.
Вправа « Хімічна розминка».(Продовжте визначення.).
Електролітична дисоціація - …
Електроліти - …
Неелектроліти - …
Чому розчини електролітів проводять електричний струм?
Приклади електролітів:
Катіони – це…
Аніони - це ...
Дати визначення кислот з точки зору теорії електролітичної дисоціації.
Дати визначення основ з точки зору теорії електролітичної дисоціації.
Дати визначення солей з точки зору теорії електролітичної дисоціації.
Ступінь електролітичної дисоціації - ….
Сильні електроліти - ….
Слабкі електроліти -….
Назвіть умови необоротності реакцій у розчині.
Дайте визначення йонним реакціям…
ІІІ. Оголошення теми уроку. Учні формулюють основні цілі уроку, свої
сподівання щодо уроку.
V. Мотивація навчальної діяльності. У 30-50 роки ХХ ст. активно розвивалася наука і техніка. Значно збільшилися обсяги хімічних виробництв. З якими проблемами стикнулося людство? (сировинна, збільшення кількості і небезпечності відходів, кислотні дощі, шкода здоров’ю) Які механізми дії цих проблем? Можливі шляхи вирішення проблем.
V. Вивчення нового матеріалу.
Бесіда. Згадайте, які явища супроводжують хімічні реакції. Ми з'ясували, що в розчині електроліти перебувають у формі йонів.
Реакції в розчинах протікають до кінця за таких умов (робимо висновок разом з учнями): (слайд № 7,8,9,10,11)
1. Утворення нерозчинної або малорозчинної речовини ;
2. Утворення газоподібної (леткої речовини);
3. Утворення малодисоційованої речовини ( наприклад - води, ступінь дисоціації дорівнює 1,8 •10-9.).
VІ. Творче застосування отриманих знань
Завдання 1 (слайд №13)
Здійсніть реакцію між речовинами, запишіть рівняння реакцій у молекулярній та йонній формах:
1) BaCl2 + Na2SO4 →
Завдання 2(слайд № 14)
Реакція обміну в розчинах електролітів з виділенням газу
2) Na2CO3 + HCl →
(Якісна реакція на йони CO23− )
Завдання 3
Реакції обміну в розчинах електролітів з утворенням води
3) NaOH + H2SO4 →
Завдання 4 (слайд № 15)
Запишіть молекулярні та повні й скорочені йонні рівняння:
AgNO3 + NaCl →
AgNO3 + HCl →
Чим відрізняються ці два рівняння? Що в них спільного?
Ag+ + Cl− → AgCl
Завдання 5 (слайд № 16)
2H+ + CO23− → H2O +CO2
Використовуючи таблицю розчинності, підберіть вихідні речовини для здійснення цієї реакції та доведіть правильність обраних речовин йонним рівнянням.
Робота в групах
Зупинка “Хто зайвий?” (слайд № 17)
Завдання: з кожних трьох йонів, поданих символами, викресліть той, що не взаємодіє з двома іншими з утворенням осаду, газу чи води. Між двома, що залишилися, складіть йонні рівняння (скорочені й повні), на їх основі, молекулярні.
І група: K+ , Al3+ , OH-
ІІ група: H+, CO32- , Na+
ІІІ група: Ba2+, Cl-, SO42-
Записати результати роботи в групах на дошці, прокоментувати.
Зупинка «Експериментальна» (слайд № 18)
Завдання: Виконати практично хімічні досліди, які доводять справедливість наведених вами в попередньому завданні молекулярних та йонних реакцій.
 Неухильно виконуйте правила техніки безпеки
Неухильно виконуйте правила техніки безпеки
Зупинка «Слідство ведуть хіміки»(слайд № 19,20)
Ситуація 1. Ви увійшли до кабінету хімії і побачили, що на столі – краплі якоїсь рідини. Відомо, що попередній клас працював з розчинами кислот і лугів. Як визначити, яка речовина розлита на столі?
Ситуація 2. У кабінеті хімії відмінник пояснював учневі, який пропустив кілька уроків через хворобу, як писати рівняння у молекулярному та іонному вигляді. Недбалий учень вирішив зашкодити їм і стер майже всі записи. На дошці залишились такі написи:
І група Fe3+ + ……. àFe(OH)3 ;
ІІ група 2H+ + SO32-à H2O + SO2 ;
ІІІ група H+ + OН-àH2O
Допоможіть відновити хімічні рівняння.
VІІ. Підведення підсумків, виставлення оцінок
Які механізми дії цих проблем?
¾ Розчинення відходів у воді та утворення розчинів електролітів
¾ Взаємодія розчинів один з одним та з об’єктами навколишнього середовища (кислотні дощі, ерозія ґрунту, забруднення рослин, зниження імунітету, вживання забрудненої їжі та води, знищення природного середовища існування організмів
¾ Вдихання відходів та утворення в організмі отруйних речовин.
Можливі шляхи вирішення проблем (встановлення якісних очисних споруд, заборона використання небезпечних продуктів хімічного синтезу, комплексне використання сировини, вторинна переробка ресурсів, знешкодження небезпечних відходів, грамотне використання засобів побутової хімії, мінеральних добрив, засобів захисту рослин, дотримання здорового способу життя, розробка альтернативних видів палива, використання сонячної енергії).
Зупинка « Від теорії до практики» (слайд № 24)
Ви - головний еколог на хімічному підприємстві. Вас хвилює проблема , як запобігти забрудненню навколишнього середовища. Для очищення води від катіонів важких і токсичних металів: Pb2+ , Cr3+ , Hg2+ , Fe3+ , їх необхідно перевести в осад. Від швидкості прийняття вами рішення залежить доля міста. Скориставшись таблицею розчинності, з'ясуйте, у вигляді яких солей можна осадити ці йони. Підтвердіть свої пропозиції йонними рівняннями реакцій.
«Незакінчене речення»(слайд № 25)
Сьогодні на уроці ми повторили основні положення …..
Ми застосували знання про електролітичну дисоціацію солей, кислот, основ для ….
Ми знаємо, що реакції у водному розчині протікають до кінця , якщо ….
Ми стикаємося з цими розчинами в нашому житті…
Ми навчилися практично застосовувати знання для …
Ми провели час на уроці з …
VІІІ. Домашнє завдання (слайд № 27)
Опрацювати матеріал параграфа 11,12, відповісти на запитання до нього, , підготуватися до практичної роботи № 2.(стор. 68)
* Скласти кросворд «Йонні рівняння»
* Розв’язати задачу «Від теорії до практики»
1. Додатково до уроку
Кросворд «Реакції йонного обміну» (слайд № 28,29)
1. Заряджені часточки, які утворюються під час дисоціації
2. Інша назва речовини, яка слабко дисоціює.
3. Назва продукту реакції, який випадає на дно пробірки.
4. Тип реакції між двома складними речовинами, під час якої вони обмінюються своїми складовими частинами.
5. Хімічні рівняння реакції, записані з використанням йонів.
6. Речовина, яка з реагуючої суміші виділяється у повітря.
2. Додатково до уроку
Самостійна робота. Підберіть вихідні речовини для здійснення реакцій
Варіант І
Hg2+ + S2− → HgS 2H+ + SiO23− → H2SiO3
Варіант ІІ
Ca2+ + CO23− → CaCO3 Fe3+ + 3OH− → Fe(OH)3
Варіант ІІІ
Al3+ + 3OH− → Al(OH)3 Zn2+ + S2− → ZnS
Додаток 2
Тема уроку: Розчин та його компоненти: розчинник, розчинена речовина. Вода як розчинник. Будова молекули води, поняття про водневий зв’язок. Фізико-хімічна суть процесу розчинення. Кристалогідрати.
Мета: формування ключових компетентностей: поглибити знання учнів з про склад розчинів; ознайомити з властивостями води як універсального розчинника; пояснювати суть процесу розчинення, розвивати знання про хімічний зв’язок і будову речовини на прикладі будови молекули води й поняття про водневий зв’язок; дати уявлення про теплові явища, що супроводжують розчинення речовин, фізико-хімічну суть процесу, розвивати поняття про розчини; познайомити учнів з чинниками, які впливають на розчинність; сформувати поняття про насичені та ненасичені розчини, концентровані і розведені; розвивати вміння спостерігати і порівнювати результати дослідів і робити висновки, встановлювати причинно-наслідкові зв’язки; розвивати довільну увагу; виховувати самостійність і працьовитість, вміння працювати в групі; екологічне виховання.
Обладнання: мультимедійна презентація до уроку, підручник «Хімія. О.В.Григорович. 9 кл.», кубик, розчини солі, крейди та олії у склянках, кристалики мідного купоросу, марганцівки, дві склянки з водою, ложечка.
Тип уроку: урок вивчення нового матеріалу.
Хід уроку
Актуалізація опорних знань
Методи і прийоми: фронтальне опитування, гра з кубиком. (слайд 2-7)
- Що називається дисперсною системою?
- Які дисперсні системи ви знаєте?
- Перед вами три склянки, в яких з водою змішані кухонна сіль, крейда і олія. Визначте тип дисперсної системи в кожній склянці.
- Чим відмінні істинні розчини від зависів?
- Пригадаємо, яку роль відіграють в нашому житті дисперсні системи.
(Гра з кубиком: учні по черзі кидають кубик один одному, називають одну дисперсну систему та її застосування в житті людини).
ІІ. Мотивація навчальної діяльності
У природі хімічні сполуки перебувають у суміші одна з одною. Утворюють різноманітні дисперсні системи. Особливо важливі водні розчини. (слайд 8,9)
- Вода в річці, морях, озерах, грунтах містить розчинні речовини. Саме у воді первісних океанів, що вкривали Землю мільйони років тому ω(солей) = 1% виникло життя.
- В середині нас: у кожній клітині є рідини, кров, лімфа.
- Розчини супроводжують нас усюди і не лише водні.
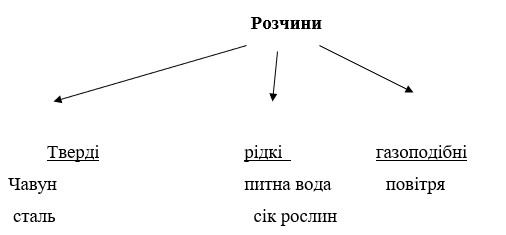
Важко уявити будь-яку галузь промисловості і техніки, де б не використовувалися розчини: розчини кислот знімають іржу, ліки, фарби, побутова хімія.
Що ж таке розчини? З яких компонентів вони складаються? Як відбувається процес розчинення? Яку роль в цьому процесі відіграє вода? Про це ми сьогодні й поговоримо.
ІІІ. Вивчення нового матеріалу.
Дослід №1 (слайд 11)
В стакан з водою кладемо мідний купорос.
- Що спостерігаєте? Завдяки дифузії вода стає блакитною.
- Як можна прискорити розчинення? Перемішати.
Дослід №2
У циліндр з водою опустимо мішечок з КМnО4.
- Що спостерігаєте?
В обох випадках після того, як речовина розчинилася, утворилася однорідна система.
Розчин – це однорідна система змінного складу, що містить два або кілька компонентів.(слайд 12)
З’ясуємо з чого складається розчин?
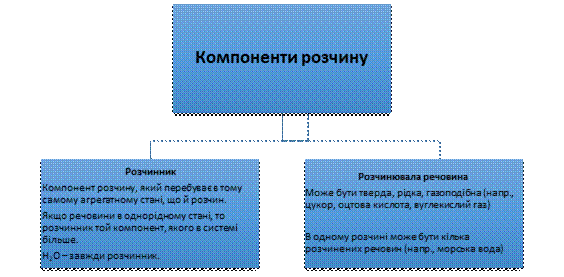
Вода - полярний розчинник
Найважливіший розчинник – вода. Це найпоширеніша на Землі складна речовина.
3 / 4 поверхні Землі вкрито водою, 65% тіло людини, 90% в огірках.
Що ви знаєте про воду?(слайд 13)
- Безбарвна рідина;
- Без запаху і смаку;
- tкип = 100°С
- tзам = 0°С
- ρ = 1 г/см3
- може бути в 3-х агрегатних станах ;
- необхідна для життя всіх організмів.
Будова молекули води (слайд 14)
Н2О - молекулярна формула

- • Молекула води полярна
- • Має кутову будову
- • Молекула води - диполь
Водневий зв’язок (слайд 15)
Водневий зв’язок – хімічний зв’язок, що виникає між атомами Гідрогену і атомами сильно електронегативних елементів (F, O, N)
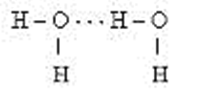 Водневий зв’язок позначається крапками
Водневий зв’язок позначається крапками
Слабший за ковалентний зв’язок
Легко розривається при випаровуванні води.
Процеси розчинення обумовлюють також водневі зв’язки.
За вмістом розчиненої речовини розрізняють такі типи розчинів (слайд 16, 17)
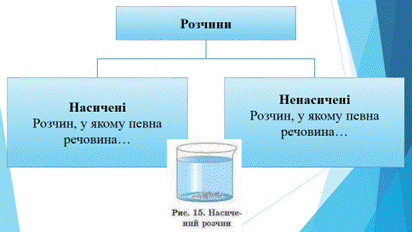
Проблемне питання:
Чи може розчин бути концентрованим і ненасиченим?(слайд 18)
Не обов’язково, щоб насичений розчин був концентрованим, а ненасичений – розбавленим. Наприклад,
- В 1 л води розчинили 1 кг цукру – розчин ненасичений, концентрований.
- В 1 л води розчинили 0,00015 г AgCl – розчин насичений, розбавлений.
Проблемне питання:
Запропонуйте способи перетворення ненасиченого розчину в насичений (слайд 19)
Суть процесу розчинення (слайд 20-22)
- Що відбувається під час розчинення речовин? Наприклад солі. Частинки однієї речовини розподіляються між частинками іншої речовини, чим більша площа поверхні стикання речовин, тим швидше розчинення. Порівняйте швидкість розчинення цукру – піску і рафінаду.
- Розчинення – це фізичний чи хімічний процес?
- Чи утворилася нова речовина? Ні. Тому процес розчинення є фізичним процесом.
- Які зміни відбувалися при розчиненні Н2SO4та NH4NO3?Виділення та поглинання теплоти. Це ознаки хімічних процесів.
Висновок: розчинення – фізико-хімічний процес.
Розчинення складається з трьох стадій: (слайд 23)
І. Гідратація - взаємодія речовини з водою (при цьому енергія виділяється)
ІІ. Руйнування кристалічної гратки речовини (при цьому енергія вбирається)
ІІІ. Дифузія – розподіл гідратованих йонів у товщі розчинника
Тепловий ефект розчинення залежить від співвідношення кількості енергії , що виділяється і поглинається у перших двох процесах.
Отже, розчинення –це складний фізико-хімічний процес, під час якого відбувається взаємодія між частинками розчинника та розчинюваної речовини.
Уточнимо визначення розчину
Розчин – це однорідна (гомогенна) система змінного складу, що містить розчинювану речовину, розчинник та продукти їх взаємодії
Розв’яжіть задачі (слайд 25)
Задача 1.
Якою буде маса розчину, якщо у 180 г води розчинили 20 г солі?
180 + 20 = 200 г
Задача 2.
Якою буде маса розчину, що утворився при розчиненні у 240 г води хлороводню, об’ємом 33,6 л.
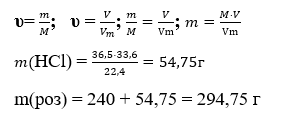
Чи однаково розчиняються різні речовини у воді? Наведіть приклади речовин, що по-різному розчиняються у воді.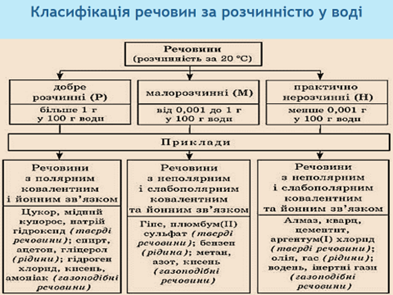
Фізкультхвилинка на закріплення класифікації речовин за розчинністю у воді: (слайд 27)
Чи однакову розчинність мають різні речовини?
Я буду називати різні речовини. Якщо речовина добре розчиняється у воді, ви показуєте якщо малорозчинна плескаєте в долоні, а якщо практично нерозчинна, робите рух долонею вправо та вліво.
Речовини: цукор, кисень, амоніак, золото, бензин, кухонна сіль, гіпс, луги, скло, гашене вапно, спирт, інертні гази, олія, сульфатна кислота.
Кристалогідрати (слайд 28) Кристалогідрати – це нестійкі кристалічні речовини, що складаються із солі та кристалізаційної води в певному стехіометричному співвідношенні.
Вода, що утримується в кристалах називається кристалізаційною .
1. CuSO4● 5 H2O - Мідний купорос
2. FeSO4 ● 7 H2O - Залізний купорос
3. Na2SO4● 10 Н2О - Глауберова сіль
4. Na2СO3● 10 Н2О - Кристалічна сода
5. CаSO4● 2 H2O - Гіпс
ІV. Закріплення і узагальнення набутих знань
Задача 1.
Обчисліть молярну масу залізного купоросу.
М(FeSO4 ● 7 H2O) = 278 г/моль
Задача 2.
Визначте масову частку води у мідному купоросі.
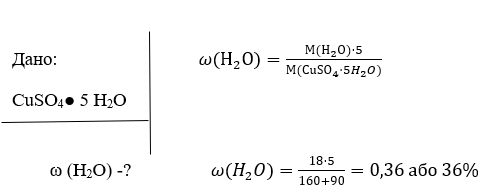
Задача 3.
Кристалогідрат Na2SO4∙ n Н2О масою 322 г прожарили. Добули безводну сіль масою 14,2 г. Визначте число молекул води у кристалогідраті.
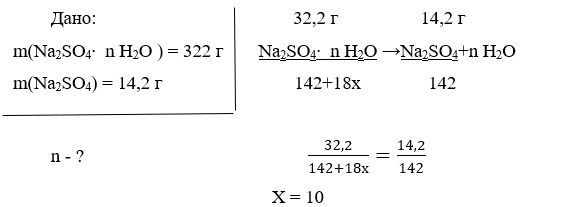
Домашнє завдання: Опрацювати § 4, 6 Впр. 63, 64,72
v Де саме та з якою метою ти та твої рідні використовують таку властивість води, як здатність розчиняти речовини.
Додаток 3
Оцет з кольоровою содою – виверження вулканів, викликає повне захоплення у малят.


Дослідження харчових продуктів на вміст крохмалю


Всі дослідження можна повторити в домашніх умовах, тільки в присутності батьків.

Додаток 4
Сценарій позакласного заходу “Хімічний марафон ”
(для учнів 9-х класів)
Мета: формувати компетентності: ключові – вміння спостерігати, аналізувати, робити висновки; здійснювати самоконтроль і само оцінювання, інформаційні – вміння осмислювати й використовувати інформацію з різних джерел (мовлення вчителя, однокласників, зміст підручника), комунікативні – вміння вільно висловлюватися, оптимально використовувати власні знання й сприйняту на уроці інформацію для результативної комунікації; соціальні – вміння продуктивно співпрацювати з однокласниками, вчителем; розвивати інтерес до вивчення хімії, поглиблення та розширення знань і кругозору учнів, їхніх умінь та навичок; розвиток інтересу до предмету, самостійності, творчої активності; виховання почуття колективізму та товариськості, відповідальності та наполегливості в досягненні поставленої мети, уміння застосовувати знання з хімії у житті, підвищувати пізнавальний інтерес до хімії та створювати ситуації успіху. Розвивати логічне мислення, виховувати бажання здобувати нові знання.
Форма проведення: гра-конкурс
Методи: словесні (розповідь, бесіда, повідомлення); гра — змагання; наочні ілюстрування, демонстрування), розв’язування задач.
Обладнання: таблиця Д.І.Менделєєва, пробірки, йод, картопля , хліб білий, оцет, сода, листи в конвертах з завданнями, стіл для проведення дослідів, секундомір, таблиці Д.І. Менделєєва
Попередня підготовка:
1) сформувати команди, продумати назви, виготовити емблеми, привітання (короткі привітання-представлення);
2) підготувати питання для конкурсів;
3) підготувати дипломи, призи переможцям.
Хід заходу:
Добрий день, добродії!
Доброго дня, панове журі!
Класні команди та
Наші вболівальники.
Свої здібності і сили
Розвиваймо раз у раз,
Щоб народу була втіха
І щоб користь була з нас.
Вчитель «Немає без працьовитості ні талантів, ні геніїв» саме цими словами видатного російського вченого Д.І. Менделєєва я хочу розпочати нашу сьогоднішню гру-турнір, яка присвячена великій науці хімії. Хімія – це область чудес, в якій сховано щастя і примноження людських благ. З огляду на сьогоднішню дату - 6 грудня День Збройних сил України, ми дійсно мужньо і чесно будемо долати труднощі, перемагати.
Наші змагання будуть проводитись між командами 9-А , 9-Б та 9-В класів. Вітаємо їх.
Вчитель.Наш турнір буде оцінювати журі у складі голови журі__________________________________________________________________
Привітання команд, представлення команд (максимально 10 балів)
Завдання 1. Розшифруйте анаграму (10 балів). Час 3хв.
1. НЕРОДГІГ - елемент, який утворює найлегший газ
2. РЕЙМІРУК - елемент, який утворює рідкий метал;
3. СЕНОГИК - елемент, який утворює газ необхідний для життя;
4. ТУНАГРЕМ - елемент, який утворює дорогоцінний метал;
5. БАНКОР - елемент - основа всіх органічних речовин.
На слайді правильна відповідь (ГІДРОГЕН, МЕРКУРІЙ, ОКСИГЕН, АРГЕНТУМ, КАРБОН) (10 балів)
Завдання 2 . Капітани виходять взяти конверти з наступним завданням.
Виконайте наступні обчислення і отримаєте відповідь, яка допоможе знайти номер наступного завдання. Перша цифра – це номер ряду , друга цифра - це номер парти. (10 балів)
ІІІ конкур
- Mr(CaCl2) + Mr(N2O) – Mr(B2O3) – Ar(Cu) = ( 21 – 2 ряд 1 парта)
- Mr(CO2) + Mr(MgCl2) – Mr(ZnO) – Ar(P) = ( 27 – 2 ряд 7 парта)
- Mr(Fe2O3) + Mr(CH4) – Mr(Al2O3) – Ar(Ca) = (34 – 3 ряд 4 парта)
Під час завдання 2 вболівальники працюють з ребусами. Правильна відповідь 5 балів.
Завдання 3.
На одному з наших перших уроків ми зупинялись на алхімічному періоді розвитку хімії. Ви тоді згадували кіногероя Гаррі Поттера. Для одного із досліджень юний вихованець школи Хогвартсу отримав невідому кристалічну речовину оранжевого кольору. Професор Сіверус Снейп розповів, що ця речовина використовується для синтезу барвників, камфори, відбілювання жирів, воску та є компонентом вибухових речовин і піротехнічних сумішей. Гаррі спробував дослідити цю речовину, підпаливши її. Видовище було захоплюючим. Спостерігаємо.
Визначити формулу речовини, якщо масова частка Нітрогену в ній 11, 11% , Гідрогену – 3,17%, а масові частки Хрому й Оксигену дорівнюють 41,27% та 44,44% відповідно. Група, яка першою виконає завдання, подає сигнал підняттям руки і отримує 10 балів.
Завдання вболівальникам
Проводиться під час виконання завдання № 3 командами.
“Хто більше ?”
Хто більше утворить назв хімічних елементів з такого набору літер (літери в назві не повторюються):
Н; А; Л; І; О; С; К; Д; Й; Т; Р; М; Г; Х; Б; У; Ю.
Час 3 хв. Перемагає команда, яка складе більше назв хімічних елементів. Кожна назва хімічного елемента – 1 бал.
Перелік назв хімічних елементів:
Бор. Натрій. Кадмій. Дубній. Кюрій. Осмій. Радій. Калій. Барій. Галій. Хлор. Бром. Йод. Магній. Торій. Уран. Борій. Станум. Радон. Карбон. Родій. Нікол. Талій. Аргон...
Конкурс – розминка
Необхідно скласти правильно формулу. Учні повинні стати так, щоб утворилась хімічна формула.
- Речовина складається з двох атомів Фосфору та п’яти атомів Оксигену.
- Речовина складається з одного атома Калію та одного атома Брому.
- Речовина складається з двох атомів Гідрогену та одного атома Сульфуру.
- Речовина складається з двох атомів Гідрогену та двох атомів Оксигену.
- Речовина складається з двох атомів Натрію, двох атомів Сульфуру та семи атомів Оксигену.
- Речовина складається з двох атомів Натрію та одного атома Сульфуру.
Конкурс «Точка зору»
Учасникам конкурсу необхідно за одну хвилину висловити власну думку з питання: «Хімія та життя: за і проти». Відповідь має бути стислою та конкретною, не менше п’яти аргументів. Відповіді записуються на папері. Однакові відповіді не зараховуються. Час для підготовки конкурсу – 1 хвилина. Один гравець – за, інший – проти, і навпаки. Одна відповідь – 1 бал.
Наприклад:

Конкурс «Відгадай та поясни»Підводяться підсумки конкурсу.
- Якось на початку ХХ століття викладач фізики однієї з Бакинських гімназій Лоран у своєму кабінеті відкрив пляшку пива, проте передумав його пити. Розмірковуючи над дослідами, Лоран (він працював з нафтою) запалив сірника, запалив і сірник випадково кинув у відро з нафтою. Спалахнуло полум’я. Лоран схопив зі столу відкриту пляшку пива і, струшуючи її, почав лити пиво на палаючу нафту. Полум’я згасло. Чому вогонь згас? (Пивна піна, що містить СО2, виконала роль ковдри, не дозволивши потрапити у відро повітрю).
- Яке море не має мешканців. Чому воно носить таку назву. (Мертве море. У 1 літрі води розчинено 250г солей Натрію і Калію. У такому соляному розчині життя неможливе).
- Історик античного світу Геродот писав, що в У столітті до нового літочислення перський цар Кір у походах користувався водою, яка зберігалася у «священних» посудинах. Під час походів воїни Олександра Македонського страждали шлунковими захворюваннями частіше, ніж військові начальники. У чому причина? (Воїни пили воду з олов’яних келихів, а начальники – зі срібних. Розчин срібла – ефективний засіб знезараження. Консервування води).
Підводяться підсумки.
Конкурс «Дуель»
У фінальній грі беруть участь троє гравців. Учитель читає запитання, той із гравців, який першим підняв руку, відповідає. Якщо відповідь неправильна, то відповідає інший гравець. Кожна правильна відповідь – 1 бал.
1. В атмосфері Землі його масова частка становить 21%. (Кисень)
2. Ці речовини називаються хімічними хамелеонами. (Індикатори)
3. Рідкий метал навіть на морозі. (Ртуть)
4. Ця кислота міститься в кефірі. (Молочна)
5. Завдяки солям цієї кислоти рослини синтезують білок. (Нітрати)
6. Цього металу багато міститься в абрикосах, персиках та цвітній капусті. (Магній)
7. Ці елементи – метали мають назви частин світу (Європій, Америцій)
8. Ця речовина в далекий геологічний час, коли на планеті Земля температура була вища за 100 градусів, перебувала у стані пари. (Вода)
9. Завдяки цьому металу острів Кіпр отримав свою назву. (Мідь)
10. Відкрив закон збереження речовини. (Ломоносов, Лавуазьє)
11. Знаходиться в центрі атома. (Ядро)
12. Наука, що вивчає речовини та їх перетворення. (Хімія)
13. Винахідник противогазу. (Зелінський)
14. Хто не плаче, а сльози течуть. (Дощ)
15. Лакмус у кислому середовищі. (Червоний)
16. З допомогою якої речовини можемо чистити яйця, не розбиваючи шкаралупи. (Кислота)
17. Яку речовину використовують у разі отруєння зіпсованою їжею для промивання шлунку (Марганцівка)
18. Негативно заряджені іони. (Аніони)
19. Якісна реакція на крохмаль. (Іод)
Ця вода стає каламутною від дихання. (Вапняна вода).
Вікторина “Чи знаєте ви хімію та географію?”
Правильна відповідь – 1б.
1.Які хімічні елементи назвали на честь частин світу? (Європій, Америцій).
2.Перерахуйте елементи, названі на честь країн. (Францій, Індій, Германій, Галій, Скандій..).
3.Назва якого елемента-метала співпадає з назвою острова ? (Купрум, від латинської назви о. Кіпр).
4.Який хімічний елемент назвали в честь штату в США? (Каліфорній).
5.Додати до назви хімічного елемента дві букви в кінці слова і назвати ріку, яка бере початок в Монголії і впадає в Байкал. (Селен - Селенга).
6. Змініть закінчення -“ій” в назві елемента на -“а”, отримаєте стару назву міста на Волзі. (Самарій - Самара)
7.Замінити першу букву в назві хімічного елемента і отримайте назву протоки між Європою та Азією.(Фосфор -- Босфор).
8.Замінити першу букву в назві елемента сімейства актиноїдів і отримайте назву держави в Азії (Уран - Іран)/
9.Замінити останню букву в назві хімічного елемента на дві однакові букви і отримаєте назву столиці Прибалтійської країни (Талій - Талінн).
10 . Додати до назви хімічного елемента назву музичної ноти, отримайте назву міста у Франції (Бор - Бордо).
11 . Замініть закінчення -“ій” в назві хімічного елемента на –“а” – отримайте назву міста-героя (Тулій - Тула).
12 . Відкиньте першу букву в назві радіоактивного елементу, отримайте чоловіче ім’я (Кюрій - Юрій).
13 . Замініть останню букву в назві хімічного елемента, отримайте назву гірської системи, яка розмежовує Європу і Азію (Уран - Урал).
14 . Відкиньте останню букву в назві хімічного елемента другої групи, отримайте назву італійського порту на Адріатичному морі (Барій - Барі).
Конкурс експериментаторів
№ 1. 1. Підказки. Елемент, на який багата морська капуста
ламінарія.
2.З домашньої аптечки він використовується для обробки ран, як антсептик (Йод). Якісний реактив на крохмаль.(На
лоточку йод, картопля , білий хліб та мед)
№ 2. 1. Органічна речовина з кислим смаком, різким запахом, використовується як консервант. (Оцет) Реакція взаємодії з содою.
№ 3. Елемент-метал, що входить до складу гемоглобіну крові (Ферум). (Як розділити суміш залізних та деревяних ошурок, солі та води)
“Відгадай загадку”
1. Куди ступиш, всюди маєш, хоч не бачиш, а вживаєш (Повітря).
2.Хто про воду, друзі, знає, коли вона замерзає?
І коли вона кипить? Точно скаже, хоч мовчить. (Термометр)
3.Мене не їдять і без мене не їдять. (Сіль).
4.Рідке, а не вода, біле, а не сніг? (Молоко).
5.У воді народжується, а води боїться. (Сіль).
6.Біле, як сніг, в пошані в усіх, подобаюсь вам, на шкоду зубам. (Цукор).
7.Не горить, а гасити доводиться. (Негашене вапно).
8.Живу в тринадцятій квартирі, відомий в цілім світі.
Я провідник прекрасний, пластичний і сріблястий. (Алюміній).
9.Попід землею вогонь летить, а на плиті обід кипить. (Газ).
10. Індикатор засмутився, червоніє - він змінився, Ой яке видовище – що за середовище? (Кисле середовище, індикатор - лакмус).
11. Без рук, без ніг, а все біжить. (Вода).
12. Убиваєш його молотом,
А воно сміється золотом. (Розпечене залізо).
13. Білий, як сніг, в пошані в усіх,
До рота попав, там і пропав. (Цукор).
14. Ви, метали, не жартуйте, з нами краще не воюйте. Вмить зруйнуємо ми вас і утворим солей клас. (Кислоти).
15. Про нього кожен учень чув,
В сім’ї сімнадцятим він був,
В Одесі учителював,
Палату мір очолював,
Змінив рівняння Клапейрона,
Відома в хімії персона. ( Д.І. Менделєєв).
Журі підводить підсумки конкурсів, визначає команду-переможницю. Вручаються:
1.Грамоти переможцям в номінації “Хіміки- інтелектуали” – І, ІІ і ІІІ місця.
2.Грамота “Найактивніший гравець”.
3. Призи капітанам команд.
І на завершення програми
Я, друзі, вам сказати хочу:
Що хімія – наука із наук,
Велична, таємнича, загадкова,
В користування нам дає
Мільйони речовин чудових.
Знання хімічні здобуваймо,
Щоб крокувати впевнено в житті
Й земні багатства зберегти.
«Сторінка – цікавинка » (під час підрахунку балів членами журі )
Цікаві факти про хімію.
Якщо ви думали, що залізо - це щось міцне і надійне, ви помиляєтеся. Залізо, нагріте до 5000 градусів Цельсія, стає газоподібним.
За одну хвилину Сонце виробляє більше енергії, ніж вся Земля витрачає за рік. Причому, ми не споживаємо всю енергію, що йде від Сонця. Та енергія, яка доходить до Землі розподіляється так: 19% сонячної енергії поглинається атмосферою, 47% - падає на Землю, а 34% - повертається в космос.
Граніт проводить звук в десять разів краще, ніж повітря. Тобто, те, що ми зазвичай добре чуємо на відстані ста метрів, було б чути за кілометр, якби між нами і джерелом звуку була суцільна гранітна стіна.
Рекордсменом за кількістю відкритих хімічних елементів є швед Карл Шеллі. Кисень, хлор, вольфрам, марганець, фтор, молібден, барій - його відкриття. На другому місці разом чотири чудових хіміка: Яком Берцеліус, Карл Монсандер (Швеція), Гемфрі Деві (Англія), Поль Лекок де Буабордан (Франція). Кожен з них відкрив 4 елементи. Ці вчені відкрили 1/4 всіх відомих на сьогоднішній день хімічних елементів.
Історія хімії багата помилковими елементами. За всю історію науки таких «хибних» елементів накопичилося 250 штук. Так з 100 представлених нібито рідкоземельних елементів істинно окремими елементами, а не сполуками виявилися лише 15.
Найвища температура створена людиною ~ 4 трлн. К, (що можна порівняти з температурою Всесвіту в перші секунди її життя), була досягнута в 2010 році при зіткненні золотих частинок, прискорених до близькосвітлових швидкостей. Експеримент був проведений на установці RHIC, розташованої в Брукхейвенській національній лабораторії, США.
Найнижча температура створена людиною нижче 5,9*10? 12К, тобто вище абсолютного нуля менш ніж на 1/170 млрд частку градуса. Ця температура в 1995 році була отримана Еріком Корнеллом і Карлом Виманом з США при охолодженні атомів рубідію.
Характерний запах монет - це не запах металу. Він виходить від сполук, що утворюються від зіткнення з металом органічних субстанцій, наприклад, людського поту. Причому щоб людина відчула цей «металевий» запах, досить дуже малої кількості реагентів.
Англійський учений Джозеф Прістлі в 1767 році зацікавився природою бульбашок, які виходять на поверхню під час бродіння пива. Над пивним чаном він помістив чашу з водою, яку потім спробував на смак, і виявив, що вона має освіжаючу дію. Прістлі відкрив ніщо інше, як вуглекислий газ, який і сьогодні використовується при виготовленні газованих напоїв. Через п'ять років Прістлі опублікував роботу, в якій описав більш досконалий метод отримання вуглекислого газу шляхом реакції сірчаної кислоти з крейдою.
Водень є першим елементом в періодичній таблиці. Він дуже легкозаймистий і є найпоширенішим елементом, знайденим в нашому всесвіті.
Гелій легший за повітря навколо нас, тому ідеально підходить для повітряних куль, які ми використовуємо на вечірках.
При нормальних умовах масло і вода не змішуються.
Слово «хімія» походить від єгипетського слова, що означає «земля».
Речі, невидимі для людського ока, часто можна побачити під ультрафіолетовим світлом, що дуже зручно для вчених і детективів.
Люди видихають вуглекислий газ (CO2). Використовуючи енергію сонячного світла, рослини перетворять вуглекислий газ в їжу в процесі, який називається фотосинтезом.
Генеральна асамблея ООН в 1994 році проголосила 16 вересня щорічним Міжнародним днем охорони озонового шару.
Для забезпечення стандартного польоту сучасного літака необхідно близько 80 тонн кисню. Стільки ж кисню виробляє 40 тисяч гектарів лісу під час фотосинтезу.
До найтоншої матерії, яку може побачити людське око, відносяться стінки мильної бульбашки.
Під дією соєвого соусу відбувається хімічна реакція, яка змушує убитого кальмара «танцювати» на тарілці.
Перехід речовини з твердого в газоподібний стан називається сублімацією в хімії.
Крім ртуті при кімнатній температурі в рідкий стан переходить францій і галій.
Вода з вмістом метану може замерзнути при температурі вище 20 градусів Цельсія.
Найпоширеніша речовина в світі це водень.
Одним з найлегших металів вважається літій.
У молодості Чарльз Дарвін був знаменитий своїми хімічними відкриттями.
На честь країн було названо велику кількість хімічних елементів.
В Індонезії люди видобувають сірку з вулкана, що приносить їм прибуток.
Сірку додають до косметичних засобів, які призначені для очищення проблемної шкіри.
Понад 100 тисяч хімічних реакції щохвилини відбувається в головному мозку людини.
Срібло відоме своїми бактерицидними властивостями, тому здатне очищати воду від вірусів і мікроорганізмів.
Половину маси Сонця становить водень.
Ернест Резерфорд був першим, кому вручили Нобелівську премію з хімії.
Спочатку платина коштувала дешевше срібла через свою тугоплавкість.
Геосмін - це речовина, яка виробляється на поверхні землі після дощу, викликаючи характерний запах.
Птахи допомагають визначити місце витоку газу, завдяки наявності в ньому запаху сирого м'яса, який додається штучним способом.
Чарльз Гуд'їр вперше винайшов гуму.
Найлегшим серед благородних газів вважається гелій.
Наприклад, коли ми ріжемо цибулю і “плачемо” – то заслуга цих фіктивних емоцій належить саме сірці, яка вбирається в грунт, де росте цибуля.
У провінції Індонезії існує вулкан, повністю заповнений сірою, який носить назву Кава Иджен. Вона осідає на трубах, після чого робочі збивають її арматурою і несуть на зважування. Там таким чином вони заробляють собі на життя.
Гігієнічні “продукти” на основі сірки створені спеціально для чистки проблемної шкіри від вугрів і висипки.
Вушна сірка, яку нас привчили видаляти ще з дитинства ватними тампонами, “отруює” наше життя з благородними намірами. У ній містяться особливі ферменти лізозіма; саме вони “не пускають” в наш організм усі бактерії.
Якщо ви думали , що залізо – міцне і надійне, ви помиляєтеся. Залізо, нагріте до 5000 градусів Цельсія, стає газоподібним .
Безліч хімічних елементів отримали свою назву на честь країн або інших географічних об’єктів. Відразу 4 елемента – ітрій , ітербій , тербий і ербій – були названі на честь шведської села Іттербю, біля якої виявили велике родовище рідкоземельних металів.
За легендою, думка про систему хімічних елементів прийшла до Менделєєва уві сні, проте відомо, що одного разу на запитання, як він відкрив періодичну систему, вчений відповів: «Я над нею, може бути, двадцять років думав, а ви думаєте: сидів і раптом … готово».
Літій – найлегший метал. Він спливає, наприклад, в гасі. Водень – найпоширеніша речовина у Всесвіті (приблизно 90 % всіх атомів у всесвіті ) . Водень – найлегший газ. Маса 1 літра водню в газоподібному стані складає всього 0,08988 грам .
Вода може замерзнути в трубопроводі при температурі +20 ° C , якщо в цій воді присутній метан ( якщо бути точніше , з води і метану утворюється газовий гідрат ) . Молекули метану «розштовхують» молекули води, так як займають більший об’єм. Це призводить до зниження внутрішнього тиску води і підвищенню температури замерзання.
У кожному літрі морської води приблизно 25 грамів солі.
У Світовому океані в 1 т води міститься приблизно 7 мг золота. А загальна маса цього металу в водах океану становить 10 млрд. тонн .
Найбільшим існуючим зараз платиновим самородком є « Уральський гігант » вагою 7 кг 860,5 р. Зберігається в Алмазному фонді Московського Кремля.
Ртуть – не єдиний метал , який перебуває в рідкому стані при кімнатній температурі. Галій ( Ga ) у руках плавиться , цезій ( Cs ) і францій (Fr) також знаходяться в рідкому стані при кімнатній температурі.
У хімії є таке поняття – сублімація , яке позначає прямий перехід речовини з твердого в газоподібний стан, минаючи рідку фазу. У побуті найчастіше таке явище зустрічається при випаровуванні сухого льоду, який перетворюється на вуглекислий газ.
Менделєєв розробив стандарт для російської горілки , чим прославився ніяк не менше, ніж відкриттям періодичної таблиці . А по-друге, Менделєєв любив виготовляти валізи, причому деякі сусіди по вулиці знали його саме як відмінного чемоданного майстра, а не геніального хіміка …
Цікава властивість срібла. У IV столітті до нашої ери війська Олександра Македонського увірвалися до Індії. На берегах річки Інд у військах вибухнула епідемія шлунково -кишкових захворювань, яка як не дивно , не торкнулася жодного воєначальника. Виявилося , що прості воїни користувалися олов’яним посудом, а їх командири – срібним. Тоді й згадали, що перський цар Кір II Великий про час військових походів наказував зберігати питну воду в срібних посудинах . Багато пізніше римські легіонери стали носити панцири, наколінники і поножі зі срібла. Срібло має бактерицидні властивості, а також сприяло швидкому загоєнню ран без нагноєнь .
Хлорид кобальту можна успішно використовувати для тайнопису : літери , написані його розчином, що містить в 25 мл води 1 г солі , абсолютно невидимі і проявляються, роблячись синіми, при легкому нагріванні паперу. Платина в перекладі з іспанскої буквально означає «серебришко». Пояснюється така зневажлива назва, дана цьому металу конкістадорами, виключно тугоплавкістю платини, яка не піддавалася переплавці, довгий час не знаходила застосування і коштувала вдвічі нижче, ніж срібло. Зараз на світових біржах платина дорожче срібла приблизно в 100 разів.
Шерлок Холмс був першим детективом , що використав хімічні знання для розкриття злочинів
Презентація 1. Реакції йонного обміну. Йонні рівняння
Презентація 2. Розчин та його компоненти
Презентація 3. Дослідження мінеральних вод України
Презентація 4. Охорона водойм Вінниці
Презентаціія 5. Подаруй річці нове життя


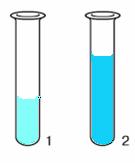 Мал. №1. Розчинення купрум (II) хлориду у воді, збільшуючи об’єм розчинника.
Мал. №1. Розчинення купрум (II) хлориду у воді, збільшуючи об’єм розчинника.
